4 Medikamentöse Therapie
4.1 Ziele der medikamentösen Therapie
Die Ziele der medikamentösen Therapie sind die Suppression der asthmatischen Entzündung, eine Verminderung der bronchialen Hyperreagibilität, eine Beseitigung bzw. Reduktion der Atemwegsobstruktion sowie das Erreichen einer bestmöglichen Asthmakontrolle.
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Die gebräuchlichsten Antiasthmatika sind zur inhalativen Applikation verfügbar. Bei Vorliegen mehrerer Darreichungsformen eines Wirkstoffes soll die inhalative Applikation bevorzugt werden. |
|
Diese Empfehlung entspricht guter klinischer Praxis und beruht auf Expertenmeinung: Durch die inhalative Applikation können in aller Regel ausreichende topische Konzentrationen im Bronchialsystem erzielt und gleichzeitig systemische (Neben-)Wirkungen weitgehend vermieden werden. Orale Medikamente sind nur bei unzureichender Wirkung inhalativer Präparate indiziert bzw. dann, wenn ein Patient ein Inhalationsmanöver nicht durchführen kann. Schwierigkeiten in der Handhabung von Inhalationssystemen stellen keinen Anlass für eine orale Applikation dar, sondern erfordern eine erneute Instruktion in das Inhalationssystem (siehe Kapitel 4.11 Inhalationssysteme).
4.2 Hinweis zum Off-Label-Use
Die in der NVL Asthma empfohlenen Therapieoptionen sind nicht für alle adressierten Patientengruppen oder Indikationen zugelassen. Auch weichen Dosisangaben in der NVL teilweise von Fachinformationen und damit von der Zulassung ab. Empfehlungen oder Angaben, die möglicherweise Off-Label-Use beinhalten, sind in der NVL nicht gesondert gekennzeichnet. Für den jeweils aktuellen Zulassungsstatus verweist die Leitliniengruppe auf die Fachinformationen der Hersteller.
Unter "Off-Label-Use" wird der zulassungsüberschreitende Einsatz eines Arzneimittels verstanden, insbesondere bei der Anwendung eines zugelassenen Arzneimittels außerhalb der von den nationalen oder europäischen Zulassungsbehörden genehmigten Anwendungsgebiete 27791.
Um die Substanzen als Off-Label-Use in der klinischen Praxis einzusetzen, müssen folgende Kriterien erfüllt sein:
- nachgewiesene Wirksamkeit;
- günstiges Nutzen-Risikoprofil;
- fehlende Alternativen – Heilversuch.
Weiterhin hat der behandelnde Arzt eine besondere Aufklärungspflicht über mögliche Konsequenzen (keine Herstellerhaftung usw.) gegenüber dem Patienten. Eine gemeinsame Entscheidungsfindung ist notwendig.
Ein "Off-Label-Use" ist dementsprechend nur bei schwerwiegenden Erkrankungen zulässig, wenn es keine Behandlungsalternative gibt. Nach dem Stand der wissenschaftlichen Erkenntnisse muss die begründete Aussicht bestehen, dass die Behandlung zu einem Erfolg führt.
4.3 Medikamentöse Stufenschemata
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Patienten mit diagnostiziertem Asthma sollen gemäß Stufenschema (siehe Abbildung 4 und Abbildung 5) behandelt werden. |
|
Abbildung 4: Medikamentöses Stufenschema | Erwachsene
(zum Vergrößern Abbildung bitte anklicken)
Abbildung 5: Medikamentöses Stufenschema | Kinder und Jugendliche
(zum Vergrößern Abbildung bitte anklicken)
4.4 Allgemeine Therapieprinzipien innerhalb des Stufenschemas
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Ein geringer Bedarf an kurzwirkenden Beta-2-Sympathomimetika (SABA) ist ein wichtiges Ziel und ein Kriterium für den Erfolg der Therapie. |
Statement |
|
Die Therapie mit inhalativen Corticosteroiden (ICS) soll bei Erwachsenen die Basis der Langzeittherapie sein. |
|
|
Die Therapie mit inhalativen Corticosteroiden (ICS) soll bei Kindern und Jugendlichen in den Therapiestufen 2 bis 6 die Basis der Langzeittherapie sein. |
|
Diese Empfehlungen beruhen auf klinischer Expertise und indirekter in der systematischen Recherche identifizierter Evidenz. Ein geringer Gebrauch der Bedarfsmedikation stellt einen Indikator für die Güte der Langzeittherapie dar und wurde in vielen systematischen Übersichtsarbeiten (wie z. B. 25875, 25074, 25686) als Endpunkt für die Wirksamkeit der untersuchten Intervention verwendet.
Inhalative Corticosteroide bilden die Basis der Langzeittherapie, weil sie die der Erkrankung zugrundeliegende Entzündung behandeln. Die Wirksamkeit verschiedener Kombinationen mit ICS wurde in zahlreichen systematischen Übersichtsarbeiten (wie z. B. 25784, 25875, 25901, 25388, 25074, 25130) geprüft. Details dieser Übersichtsarbeiten werden bei den jeweiligen Stufen diskutiert.
Eine Langzeittherapie ist eine auf Dauer angelegte Therapie. Auch die bedarfsorientierte Anwendung der Fixkombination aus ICS niedrigdosiert und Formoterol ist als eine Form der Langzeittherapie anzusehen.
Zur Unterstützung der Aufklärung und Beratung der Patienten über die Wichtigkeit der Langzeittherapie mit ICS wurde das Patientenblatt "Asthma: Behandlung mit Kortison-Spray" entwickelt (siehe Patientenblätter bzw. abrufbar unter www.asthma.versorgungsleitlinien.de).
Monotherapie mit inhalativen langwirkenden Beta-2-Sympathomimetika (LABA) oder Anticholinergika (LAMA)
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Es soll keine Monotherapie mit einem inhalativen langwirkenden Beta-2-Sympathomimetikum (LABA) durchgeführt werden. |
|
|
Es soll keine Monotherapie mit einem inhalativen langwirkenden Anticholinergikum (LAMA) durchgeführt werden. |
|
Die Grundlage für die Formulierung der Empfehlung 4-6 bildet die im Jahr 2008 von Levenson veröffentlichte 26920 und 2010 von der U.S. Food and Drug Administration (FDA) 26921 bewertete Metaanalyse zur Sicherheit von LABA. Diese schloss 110 Studien mit insgesamt 60 954 Patienten ein. Die Ergebnisse wiesen darauf hin, dass die Therapie mit LABA das Risiko für schwere Exazerbationen der Asthmasymptome, die zu Hospitalisierungen oder Todesfällen führen, erhöhte. In der Folge riet die FDA von der Monotherapie mit LABA ab. 26920, 26921
Monotherapie bezeichnet hier die Anwendung von LABA ohne ICS. Im Gegensatz zu ICS haben LABA keine entzündungshemmenden Eigenschaften. Bei einer LABA-Monotherapie besteht durch die langanhaltende bronchodilatative Wirkung die Gefahr, dass die Asthmasymptome bei erhaltener Entzündung kaschiert werden. Wegen des damit verbundenen erhöhten Morbiditäts- und Mortalitätsrisikos spricht die Leitliniengruppe eine starke Negativempfehlung aus.
Das Zentralinstitut für die kassenärztliche Versorgung (Zi) analysierte die Häufigkeit einer Monotherapie mit LABA mit Hilfe von Routinedaten 27767. Ausgeschlossen wurden u. a. Patienten, für die im Analysejahr zusätzlich die Diagnose COPD kodiert wurde. 28,2% dieser verbleibenden Patienten mit der Diagnose Asthma erhielten zumindest zeitweise eine Monotherapie mit einem LABA 27767. Dieser eher hohe Wert lässt sich möglicherweise dadurch erklären, dass Patienten eine ICS-Verordnung zwar erhielten, aber nicht einlösten.
Zur Unterstützung der Aufklärung und Beratung der Patienten über die Wichtigkeit der Langzeittherapie mit ICS wurde das Patientenblatt "Asthma: Behandlung mit Kortison-Spray" entwickelt (siehe Patientenblätter bzw. abrufbar unter www.asthma.versorgungsleitlinien.de).
Die Leitliniengruppe folgt der Empfehlung der FDA und spricht diese auch für die Monotherapie von LAMA aus. Für deren Anwendung als Monotherapie wurden keine systematischen Übersichtsarbeiten identifiziert. Nach Kenntnis der Autoren stehen derzeit noch keine Langzeitdaten zur Verfügung.
4.4.1 Vergleichstabelle der Dosierungen inhalativer Corticosteroide
Zur Dosierung der ICS werden in der NVL die Kategorien "niedrigdosiert", "mitteldosiert" und "hochdosiert" sowie bei Erwachsenen zusätzlich "Höchstdosis" verwendet. Die Tabelle 6 und die Tabelle 7 basieren auf der klinischen Einschätzung der Leitliniengruppe, der GINA 2017 26435 sowie für Erwachsene zusätzlich auf der ERS/ATS-Leitlinie 2014 26481. Die "Höchstdosis" der ERS/ATS-Leitlinie ist insbesondere für die Definition für "schweres Asthma" (siehe Statement 1-1) relevant.
Die Vergleichstabellen der Dosierungen inhalativer Corticosteroide – im Folgenden ICS-Vergleichstabellen genannt – bieten eine Orientierung für den Anwender und sollen dabei helfen, von einem Wirkstoff auf den anderen zu wechseln. Sie entbinden den Arzt nicht aus seiner Sorgfalts- und Prüfpflicht, sich an den Herstellerangaben und der Zulassung zu orientieren.
ICS unterscheiden sich hinsichtlich ihres Sicherheitsprofils. In Tabelle 7 (Kinder und Jugendliche) werden keine Dosierungsangaben für die Hochdosistherapie mit den Wirkstoffen Beclometasondipropionat (BDP) und Budesonid ausgesprochen. Grundlage dafür sind Sicherheitsbedenken im Hinblick auf die Plasmaspiegel. Dabei ist zu beachten, dass der Verweis auf Plasmaspiegel nicht hinreichend ist, um die Wirkstoffe BDP und Budesonid komplett aus der Hochdosistherapie zu nehmen. Neben den Plasmaspiegeln sind auch die relative Rezeptorbindungsaffinität sowie ein mögliches, je nach Inhalationsgerät abweichendes Depositionsverhalten relevant. Einen weiteren Gradmesser für das Risiko systemischer Störeffekte bildet der therapeutische Index.
Tabelle 6: Vergleichstabelle der Dosierungen inhalativer Corticosteroide | Erwachsene
|
Vergleichstabelle der Dosierungen inhalativer Corticosteroide (ICS) (modifiziert nach 26435 und 26481) | Erwachsene |
||||
|---|---|---|---|---|
|
Die ICS-Vergleichstabelle beruht auf der klinischen Einschätzung der Leitliniengruppe. Dabei handelt es sich nicht um eine Dosieranleitung. Die Tabelle gibt eine Orientierung, welche Dosierungen für die einzelnen Wirkstoffe in welchen Dosierungsbereich fallen und soll helfen, von einem Wirkstoff auf einen anderen zu wechseln. Teilweise weichen die Dosisangaben stark von Fachinformationen und damit von der Zulassung ab. Einige Beclometasondiproprionat-haltige Formulierungen ermöglichen eine feinere Partikelgrößenverteilung bei der Arzneistoffabgabe und damit eine höhere Lungendeposition des Arzneistoffs. Daraus ergeben sich die unterschiedlichen BDP-Dosierungen, die bei einem Präparatewechsel zu berücksichtigen sind. |
||||
|
Wirkstoff (ICS); Dosis pro Tag in Mikrogramm |
niedrige Dosis |
mittlere Dosis |
hohe Dosis |
Höchstdosis* |
|
Beclometasondipropionat (BDP) – Standardpartikelgröße |
200-500 |
> 500-1 000 |
> 1 000 |
≥ 2 000 |
|
Beclometasondipropionat (BDP) – feine Partikelgröße |
100-200 |
> 200-400 |
> 400 |
≥ 1 000 |
|
Budesonid |
200-400 |
> 400-800 |
> 800 |
≥ 1 600 |
|
Ciclesonid |
80 |
160 |
≥ 320 |
≥ 320 |
|
Fluticasonfuroat |
100 |
100 |
200 |
200 |
|
Fluticasonpropionat |
100-250 |
> 250-500 |
> 500 |
≥ 1 000 |
|
Mometasonfuroat |
200 |
400 |
> 400 |
≥ 800 |
|
* Dosierungsempfehlungen gemäß ERS/ATS-Empfehlung 26481 bei schwerem Asthma bzw. in der Stufe 5 des Stufenschemas (siehe Abbildung 4) |
||||
Tabelle 7: Vergleichstabelle der Dosierungen inhalativer Corticosteroide | Kinder und Jugendliche
|
Vergleichstabelle der Dosierungen inhalativer Corticosteroide (ICS) (modifiziert nach 26435) | Kinder und Jugendliche |
||||||
|---|---|---|---|---|---|---|
|
Die ICS-Vergleichstabelle beruht auf der klinischen Einschätzung der Leitliniengruppe. Dabei handelt es sich nicht um eine Dosieranleitung. Die Tabelle gibt eine Orientierung, welche Dosierungen für die einzelnen Wirkstoffe in welchen Dosierungsbereich fallen und soll helfen, von einem Wirkstoff auf einen anderen zu wechseln. Teilweise weichen die Dosisangaben stark von Fachinformationen und damit von der Zulassung ab. Hinweise zu den Wirkstoffen:
Dosisangaben für Jugendliche: Jugendliche mit Asthma sind eine sehr heterogene Patientengruppe. Es muss jeweils individuell beurteilt werden, ob ein Jugendlicher Dosierungen gemäß der Kinder- oder Erwachsenen-Tabelle erhalten soll. Dabei ist es wichtig, Sicherheitsbedenken gegen eine mögliche Unterdosierung abzuwägen. Die Dosisangaben umfassen daher die Spanne zwischen Kindern und Erwachsenen. |
||||||
|
Wirkstoff (ICS); Dosis pro Tag in Mikrogramm |
niedrige Dosis |
mittlere Dosis |
hohe Dosis |
|||
|
Kinder < 12 Jahre |
Jugendliche 12-18 Jahre |
Kinder < 12 Jahre |
Jugendliche 12-18 Jahre |
Kinder < 12 Jahre |
Jugendliche 12-18 Jahre |
|
|
Beclometasondipropionat (BDP) – Standardpartikelgröße |
≤ 200 |
≤ 200* |
> 200-400 |
> 200-400* |
–* |
–* |
|
Beclometasondipropionat (BDP) – feine Partikelgröße |
≤ 100 |
≤ 100* |
> 100-200 |
> 100-200* |
–* |
–* |
|
Budesonid |
≤ 200 |
≤ 200* |
> 200-400 |
> 200-400* |
–* |
–* |
|
Ciclesonid |
– |
80 |
– |
160 |
– |
> 160 |
|
Fluticasonfuroat |
– |
– |
– |
100 |
– |
> 100 |
|
Fluticasonpropionat |
≤ 100 |
≤ 100 |
> 100-200 |
> 100-250 |
> 200 |
> 250 |
|
Mometasonfuroat |
– |
200 |
– |
400 |
– |
> 400 |
|
* Bei BDP und Budesonid bestehen aus Sicht der Autoren Sicherheitsbedenken im Hinblick auf die Plasmaspiegel. Daher gleichen die Dosisangaben der Jugendlichen denen der Kinder jeweils für den niedrigen und mittleren Dosisbereich. Im hohen Dosisbereich werden die genannten Wirkstoffe von der Leitliniengruppe eher nicht empfohlen (deshalb dort auch keine Dosisangaben). |
||||||
4.5 Orientierung der Stufentherapie an der Asthmakontrolle
Die Asthmakontrolle bildet die Grundlage für eine Entscheidung zur Therapieanpassung (siehe Empfehlung 2-15). Wichtig für den behandelnden Arzt ist, diese wiederholt zu beurteilen und geeignete Strategien zu wählen, die das erzielte gute Therapieergebnis im Verlauf erhalten.
Die medikamentöse Asthmatherapie zielt darauf ab, den Status eines kontrollierten Asthmas (siehe Statement 2-14, Abbildung 2 und Abbildung 3) nach dem Prinzip "so viel wie nötig, jedoch so wenig wie möglich" zu erreichen und diesen aufrechtzuerhalten. Dies entspricht guter klinischer Praxis und beruht auf Expertenmeinung.
|
Abbildung 6: Therapieanpassung orientiert an der Asthmakontrolle |
|---|
4.5.1 Therapieintensivierung
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Falls keine Asthmakontrolle mit der Therapie erzielt wird, sollen zunächst verschiedene Aspekte berücksichtigt werden, bevor die Therapie intensiviert wird:
(siehe Abbildung 6) |
|
|
Bei unkontrolliertem Asthma soll eine Intensivierung der Therapie den Stufenschemata folgend empfohlen werden. |
|
|
Bei teilweise kontrolliertem Asthma sollte eine Intensivierung der Therapie den Stufenschemata folgend erwogen werden. |
|
|
Nach einer Intensivierung der Langzeittherapie gemäß Stufenschemata soll die Asthmakontrolle innerhalb von drei Monaten überprüft werden. |
|
Die Empfehlungen 4-8 bis 4-11 entsprechen guter klinischer Praxis. Die Formulierungen wurden auf Basis der 2. Auflage der NVL Asthma modifiziert und spiegeln die klinische Einschätzung der Leitliniengruppe wider.
Vor einer Therapieintensivierung empfiehlt die Leitliniengruppe, beeinflussbare Ursachen für eine unzureichende Asthmakontrolle zu prüfen, um eine ggf. unnötige Erhöhung der Wirkstoffexposition zu vermeiden. Wichtig ist dabei auch die Beachtung möglicher Auslösefaktoren und Komorbiditäten, die sich aggravierend auf den Krankheitsverlauf auswirken können (siehe Empfehlung 2-1).
Während die Leitliniengruppe bei Patienten mit unkontrolliertem Asthma anschließend eine Therapieintensivierung empfiehlt, äußert sie sich bei teilweise kontrolliertem Asthma zurückhaltender. Hier muss man den geringeren zusätzlichen therapeutischen Nutzen gegen den erforderlichen Aufwand abwägen. Dies gilt umso mehr, als dass bei teilweise kontrolliertem Asthma die Symptomatik geringer ist. Die Adhärenz und damit die Bereitschaft des Patienten, den zusätzlichen therapeutischen Aufwand auch tatsächlich zu erbringen, ist dabei ausschlaggebend in der Entscheidungsfindung (siehe Kapitel 3 Therapieplanung und gemeinsame Entscheidungsfindung).
Nach einer Intensivierung der Langzeittherapie wird empfohlen, die Asthmakontrolle nach drei Monaten erneut zu überprüfen. Die Rationale für die Empfehlung ist, dass der maximal erreichbare Effekt der Therapieanpassung unter Umständen erst nach diesem Zeitraum beurteilbar ist. Eine Ausnahme bildet die Initiierung der Therapie mit monoklonalen Antikörpern (siehe Empfehlung 4-38).
4.5.2 Therapiereduktion
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Vor einer möglichen Reduktion der Therapie soll das Asthma für mindestens drei Monate kontrolliert sein. |
|
|
Bei Patienten mit saisonalem Asthma sollte die Therapie an die saisonale Pollenexposition angepasst werden. |
|
|
Patienten mit Asthma sollen darauf hingewiesen werden, dass jede Beendigung einer Langzeittherapie mit entweder oralen oder inhalativen Corticosteroiden eine mögliche Gefährdungssituation darstellt. |
|
|
Wird eine Therapie mit Corticosteroiden oder monoklonalen Antikörpern abgesetzt, sollen Patienten engmaschig überwacht werden. |
|
Die Empfehlungen beruhen auf der klinischen Erfahrung der Leitliniengruppe und drei, in der systematischen Recherche identifizierten, systematischen Übersichtsarbeiten zur Therapiereduktion von ICS 25106, 25358, 25777.
Gionfriddo et al. 25106 untersuchten den Effekt der Reduktion einer kontinuierlichen ICS-Therapie zu einer intermittierenden im Vergleich zur Beibehaltung der ICS-Therapie bei Patienten, die zuvor mindestens vier Wochen keine Exazerbationen aufwiesen. Hier errechnete sich ein relatives Risiko für Exazerbationen in einem Beobachtungszeitraum von sechs bis zehn Monaten von 1,32 ((95% KI 0,81; 2,16); I² = 0%, 2 RCTs, n = 377, Datenqualität niedrig). Patienten mit gleichbleibender ICS-Dosis berichteten von mehr Tagen mit adäquater Asthmakontrolle als Patienten mit reduzierter Dosis (SMD 0,26 (95% KI 0,02; 0,49); I² = 22%, 2 RCTs, n = 377, Datenqualität niedrig), wobei die klinische Relevanz des Unterschiedes unklar ist. 25106
Hagan et al. 25358 analysierten Exazerbationen nach ICS-Reduktion bei Patienten nach vierwöchiger stabiler Dosierung. Im Gegensatz zu Gionfriddo et al. waren Exazerbationen in den vier Wochen vor der Intervention kein Ausschlusskriterium 25106, 25358. Innerhalb einer durchschnittlichen Studiendauer von 22 Wochen erlitten Patienten mit beibehaltener ICS-Dosis 0,17 Exazerbationen und Patienten mit reduzierter Dosis 0,21. Die gepoolte absolute Risikodifferenz war 0,02 ((95% KI 0,02; 0,07); I² = 0%, 6 RCTs, n = 884, Datenqualität sehr niedrig). Asthmasymptome und asthmabezogene Lebensqualität unterschieden sich nicht signifikant zwischen den Gruppen. 25358
Rank et al. 25777 fokussierten auf das Risiko für Exazerbationen nach Absetzen eines niedrig dosierten ICS bei zuvor vierwöchiger stabiler ICS-Therapie. Nach dem Absetzen von ICS waren Exazerbationen etwas häufiger als bei unveränderter Therapie (0,16 vs. 0,38; absolute RD 0,23 (95% KI 0,16; 0,30); I² = 44%, 7 RCTs, n = 1 040, Datenqualität niedrig). Auch die Asthmasymptome waren bei Patienten, die die Therapie absetzten, verstärkt. 25777
Um eine Übertherapie zu vermeiden, ist es wichtig, die Asthmakontrolle in regelmäßigen Abständen zu überprüfen und die Therapie ggf. zu reduzieren. Die zitierten Studien verwenden einen vierwöchigen Zeitraum ohne Exazerbationen bzw. mit stabiler ICS-Therapie als Voraussetzung für die Therapiereduktion. Das ist nach Einschätzung der Leitliniengruppe zu kurz. Die Studien können daher nur als indirekte Evidenz für die Therapiereduktion dienen. Auf Basis klinischer Erfahrung wird die Reduktion der Therapie erst nach einem mindestens dreimonatigen Zeitraum stabiler Asthmakontrolle empfohlen.
Davon ausgenommen sind Patienten mit saisonalem Asthma. Hier orientiert sich die Therapie an der saisonalen Pollenexposition, sodass eine Reduktion bereits nach kürzeren Zeiträumen möglich wird. Da die Vermeidung einer Übertherapie im Kindesalter besonders relevant ist, kann ggf. versucht werden, die Therapie bereits nach zwei Monaten mit stabiler Asthmakontrolle zu reduzieren.
Setzen Patienten Corticosteroide eigenmächtig ab, kann dies zu einer Verschlechterung der Asthmakontrolle und zu Exazerbationen führen. Das Absetzen von Corticosteroiden und monoklonalen Antikörpern erfordert eine engmaschige Überwachung durch den behandelnden Arzt, um bei sich verschlechternder Asthmakontrolle die Therapie entsprechend anzupassen. Der Einsatz von OCS im Rahmen einer Exazerbation wird nicht als Langzeittherapie gewertet. Für die Reduktion von LABA oder anderen Langzeittherapeutika erachtet die Leitliniengruppe ein situatives und individualisiertes Vorgehen für sinnvoll.
4.6 Bedarfstherapie
4.6.1 Bedarfstherapie | Alle Altersgruppen
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei erwachsenen Patienten soll in jeder Therapiestufe ein Bedarfsmedikament (SABA oder Fixkombination aus ICS und Formoterol) eingesetzt werden, um akut auftretende Symptome zu behandeln. |
|
|
Bei Kindern und Jugendlichen soll in jeder Therapiestufe ein Bedarfsmedikament eingesetzt werden, um akut auftretende Symptome zu behandeln. Anstelle der gebräuchlichen Bedarfstherapie mit einem SABA, ergibt sich für Jugendliche ab 12 Jahren unter speziellen Voraussetzungen (siehe Abbildung 5) auch die Möglichkeit der Anwendung einer Fixkombination aus ICS und Formoterol. |
|
4.6.1.1 Kurzwirkende Beta-2-Sympathomimetika (SABA)
In der systematischen Recherche zur 3. Auflage wurden keine hochwertigen systematischen Übersichtsarbeiten zur Anwendung von SABA identifiziert. Sie ist breit implementiert, sodass von der Leitliniengruppe zu dieser Fragestellung keine neueren RCTs bzw. Metaanalysen erwartet werden. Gestützt wird die Empfehlung von SABA dadurch, dass in vielen systematischen Übersichtsarbeiten (z. B. 25901, 25074, 25388) SABA als Bedarfsmedikation Einschlusskriterium war.
4.6.1.2 Fixkombination aus ICS niedrigdosiert und Formoterol: bedarfsorientiert in Stufe 1
Nach Beendigung der systematischen Recherche zur Wirksamkeit und Sicherheit der bedarfsorientierten Anwendung der Fixkombination aus ICS niedrigdosiert und Formoterol in Stufe 1 und 2 wurde eine randomisiert kontrollierte, jedoch nicht verblindete Studie veröffentlicht 29390. Eingeschlossen wurden Patienten mit mildem Asthma ab 18 Jahren, deren einzige Therapie der vorherigen drei Monate aus SABA bestand. Diese sollte in den letzten 4 Wochen durchschnittlich nicht häufiger als zweimal pro Tag angewandt worden sein. Die Randomisierung erfolgte zu den drei Gruppen Albuterol (= Salbutamol) bedarfsorientiert, freie Kombination aus Budesonid als Langzeittherapie plus Albuterol bei Bedarf sowie der ausschließlich bedarfsorientierten Anwendung der Fixkombination aus Budesonid und Formoterol. Die relative Rate der Exazerbationen pro Patient pro Jahr war bei Anwendung der Fixkombination geringer als unter Albuterol allein (absolute Rate 0,195 vs. 0,400; relative Rate 0,49 (95% KI 0,33; 0,72)). Im Vergleich zwischen der Fixkombination und der freien Kombination errechnete sich kein signifikanter Unterschied für die relative Rate von Exazerbationen pro Patient pro Jahr (absolute Rate 0,195 vs. 0,175; relative Rate 1,12 (95% KI 0,70; 1,79)). Patienten mit mindestens einer unerwünschten Wirkung waren in der Gruppe der freien Kombination am häufigsten, (n = 190 (83,7%); Albuterol allein: n = 185 (81,9%), Fixkombiantion n = 174 (78,4%)). Patienten mit mindestens einer schweren unerwünschtung Wirkung wurden am häufigsten in der Gruppe der Fixkombination identifiziert (n = 13 (5,9%), freie Kombination: n = 7 (3,1%), Albuterol allein: n = 6 (2,7%)). 29390 In der methodischen Bewertung wird ein hohes Risiko für Performance Bias und ein unklares Risiko in den Katerorien Detection, Attrition und Reporting Bias gesehen.
Die Leitliniengruppe empfiehlt die bedarfsorientierte Anwendung der Fixkombination aus ICS niedrigdosiert und Formoterol in Stufe 1 vor allem für die Patienten, die mit SABA allein nicht ausreichend kontrolliert, aber für eine ICS-Langzeittherapie nicht adhärent genug sind. Die klinische Erfahrung zeigt, dass es häufig Patienten gibt, die das SABA mehr als zweimal pro Woche inhalieren, ohne dies zu kommunizieren. Anhand der Häufigkeit der Verschreibungen könnte dies auffallen und die Langzeittherapie mit ICS initiiert werden. Hier berichtet die Leitliniengruppe jedoch von Problemen in der Versorgung: Die Initiierung der ICS-Langzeittherapie fehle unter anderem deshalb, weil bei einigen Patienten eine geringe Adhärenz zur regelmäßigen Anwendung von ICS bestehe.
Das nicht verblindete Studiendesign der Novel START-Studie 29390 erscheint der Leitliniengruppe hilfreich, um die Population abzubilden, für die das oben beschriebene Versorgungsproblem vorliegt. Da diese Patientengruppe nicht immer eindeutig identifiziert werden kann, empfiehlt die Leitliniengruppe die Anwendung der Fixkombination in Stufe 1. Die unter Umständen entstehende Übertherapie derer, die auch mit SABA allein kontrolliert gewesen wären, nimmt sie in Kauf. Wenn sichergestellt werden kann, dass Patienten mit SABA allein gut kontrolliert sind und sie dies nicht häufiger als zweimal pro Woche anwenden (siehe Empfehlung 4-18), ist die Anwendung der Fixkombination aus Sicht der Leitliniengruppe nicht nötig. Darüber hinaus weist die Leitliniengruppe darauf hin, dass die Anwendung der Fixkombination aus ICS niedrigdosiert und Formoterol in Stufe 1 nicht notwendig ist, wenn Patienten bereits hier als Ausnahme in begründeten Fällen eine Langzeittherapie mit einem niedrig dosierten ICS erhalten (siehe Abbildung 4).
Patienten unter 18 Jahren sind in der Novel START-Studie zwar nicht abgebildet 29390, die Leitliniengruppe entscheidet sich aber, die Ergebnisse indirekt zu nutzen. Aus ihrer Erfahrung ist die Adhärenz zur regelmäßigen Inhalation von ICS bei Jugendlichen besonders schwach. Da der häufige Gebrauch von SABA die Symptome des Asthmas kaschiert, ohne die Entzündung zu behandeln, erhöht sich das Risiko für Exazerbationen. Die Leitliniengruppe empfiehlt daher die bedarfsorientierte Anwendung der Fixkombiantion aus ICS niedrigdosiert und Formoterol in Stufe 1 (siehe Abbildung 5).
Bei der bedarfsorientierten Anwendung der Fixkombination in Stufe 1 ist es wichtig, die jeweilige Tageshöchstdosis des ICS bzw. des Formoterols nicht zu überschreiten.
Hinweis zum Off-Label-Use
Empfehlungen oder Angaben, die möglicherweise Off-Label-Use beinhalten, sind in der NVL nicht gesondert gekennzeichnet. Da es sich bei der ausschließlich bedarfsorientierten Anwendung von ICS niedrigdosiert und Formoterol in Stufe 1 jedoch um ein neues Therapiekonzept handelt, weist die Leitliniengruppe an dieser Stelle als Ausnahme darauf hin, dass zum Zeitpunkt der Aktualisierung der NVL Asthma zur 4. Auflage keine Zulassungserweiterung für diese Indikation in Deutschland oder im EU-Ausland identifiziert wurde (siehe Kapitel 4.2 Hinweis zum Off-Label-Use).
Die Evidenzlage zur bedarfsorientierten Anwendung der Fixkombination aus ICS niedrigdosiert und Formoterol als neues Konzept der Langzeittherapie wird im Kapitel 4.8.1.2 Fixkombination aus ICS niedrigdosiert und Formoterol: bedarfsorientiert erläutert.
4.6.1.3 Fixkombination aus ICS und Formoterol wenn diese auch die Langzeittherapie darstellt
Zum Einsatz der Fixkombination aus ICS plus Formoterol als Bedarfsmedikation, wenn diese auch die Langzeittherapie darstellt, wurden in der systematischen Recherche zur 3. Auflage mehrere systematische Übersichtsarbeiten identifiziert. Die Ergebnisse können teilweise nur indirekt als Empfehlungsbegründung herangezogen werden, da Interventions- und Kontrollgruppen unterschiedliche Langzeittherapien erhielten. Deshalb können die in den Interventionsgruppen beobachteten Effekte nicht sicher nur auf die Verwendung der Fixkombination als Bedarfstherapie zurückgeführt werden.
Kew et al. 25667 verglichen die Fixkombination Formoterol und Budesonid als Langzeit- und Bedarfstherapie (Interventionsgruppe) mit einer Fixkombination aus einem höher dosierten ICS plus LABA bei zusätzlicher Bedarfstherapie mit einem SABA. Untersucht wurden Jugendliche und Erwachsene. Exazerbationen, die eine Behandlung mit OCS erforderten, traten in der Interventionsgruppe seltener auf (OR 0,75 (95% KI 0,65; 0,87); I² = 0%, 4 RCTs, n = 9 096, Datenqualität hoch). Auch die Anzahl der Patienten mit mindestens einer schweren Exazerbation, die eine Hospitalisierung oder das Aufsuchen einer Notaufnahme nach sich zog, war in der Interventionsgruppe seltener (OR 0,72 (95% KI 0,57; 0,90); I² = 0%, n = 7 768, 3 RCTs, Datenqualität hoch). Die Lebensqualität verbesserte sich in der Interventionsgruppe signifikant, jedoch nicht klinisch relevant. In den Gruppen traten ähnlich viele schwere unerwünschte Wirkungen auf. 25667
Cates et al. 25750 verglichen die Fixkombination Formoterol und Budesonid, die als Langzeit- und Bedarfstherapie fungiert (Interventionsgruppe) mit einer ICS-Monotherapie und separater Bedarfsmedikation. Das Risiko für Exazerbationen, die eine Behandlung mit OCS erforderten, war bei Jugendlichen und Erwachsenen in der Interventionsgruppe geringer (OR 0,54 (95% KI 0,45; 0,64); I² = 7%, 4 RCTs, Datenqualität hoch). Schwere unerwünschte Wirkungen unterschieden sich nicht signifikant. 25750
In einem weiteren Cochrane-Review von Cates et al. 25911 wurden die Wirksamkeit und Sicherheit einer Fixkombination aus Formoterol und Budesonid als Bedarfsmedikation (Interventionsgruppe) mit einer Bedarfsmedikation aus Terbutalin verglichen. Die Langzeittherapie bestand in beiden Gruppen aus einer Kombination von ICS und LABA. Erwachsene wiesen in der Interventionsgruppe ein geringeres Risiko für Exazerbationen auf, die eine Behandlung mit OCS benötigen (OR 0,54 (95% KI 0,44; 0,65); I² = 0%, 2 RCTs, n = 3 838, Datenqualität moderat). Die Anzahl schwerer unerwünschter Wirkungen und Todesfälle unterschied sich nicht signifikant zwischen den Gruppen. Kinder hatten ein geringeres Risiko für schwere unerwünschte Wirkungen, wenn sie die Fixkombination als Bedarfsmedikation erhielten (OR 0,11 (95% KI 0,02; 0,48); 1 RCT, n = 235, Datenqualität niedrig). 25911
Formoterol besitzt bei raschem Wirkungseintritt eine lange Wirksamkeit. Die Autoren empfehlen diesen Wirkstoff jedoch nicht mehr als Mono-Bedarfsmedikament. Grundlage für diese Entscheidung sind die Ergebnisse der Metaanalyse aus dem Jahr 2008 26920, seit deren Bewertung durch die FDA von der Monotherapie mit langwirkenden Beta-2-Sympathomimetika abgeraten wird 26921 (siehe Empfehlung 4-6).
Daten des Zentralinstituts für die kassenärztliche Versorgung zeigen, dass etwas weniger als die Hälfte (43%) der Patienten, die eine Fixkombination aus einem ICS und Formoterol erhielten, zusätzlich ein SABA erhielten 27767. Bei den anderen Patienten wird vermutet, dass sie die Fixkombination auch als Bedarfsmedikation verwenden. Es ist jedoch nicht auszuschließen, dass diese Patienten vor und/oder nach dem betrachteten Analysezeitraum ein SABA erhalten haben.
Auf Basis der zitierten Evidenz, der Analyse der Routinedaten und der klinischen Erfahrung sprechen die Autoren eine Empfehlung für die bedarfsorientierte Anwendung der Fixkombination aus ICS und Formoterol aus, wenn diese gleichzeitzig die Langzeittherapie der Patienten darstellt (siehe Abbildung 4 und Abbildung 5) aus. Die Fixkombination hat den Vorteil, dass eine versehentliche Monotherapie mit Formoterol und Verwechslungen der Inhalationssysteme verhindert werden. Die Leitliniengruppe gibt dabei jedoch zu bedenken, dass Patienten durch die Anwendung einer Fixkombination als Bedarfsmedikation in den Stufen 3 bis 5 bei Erwachsenen bzw. 4 bis 6 bei Jugendlichen unter Umständen höheren ICS-Dosen pro Tag ausgesetzt sind, als wenn sie ein SABA als Bedarfsmedikament nutzen. Darüber hinaus ist bei höher dosierten Kombinationspräparaten aus ICS und Formoterol die Tageshöchstdosis von Formoterol zu beachten und der Patient bei der bedarfsorientierten Anwendung darauf hinzuweisen.
4.6.1.4 Ipratropiumbromid
In einer selektiven Suche wurde ein Cochrane-Review 26786 identifiziert, der die Anwendung von SABA mit der Kombinationstherapie aus SABA und anticholinergen Substanzen bei Erwachsenen verglich. Einschlusskriterium waren stattgehabte Exazerbationen, die eine Vorstellung in einer Notaufnahme erforderlich machten. Unter der Kombinationstherapie war das Risiko für Hospitalisierungen geringer (RR 0,72 (95% KI 0,59; 0,87); I² = 12%, 16 Studien, n = 2 120, moderate Datenqualität), jedoch das Risiko für unerwünschte Wirkungen erhöht (OR 2,03 (95% KI 1,28; 3,20); I² = 14%,11 Studien, n = 1 392, moderate Datenqualität). 26786 Die Leitliniengruppe schätzt die Stärke des Effektes als nicht ausreichend ein, um eine Kombinationstherapie aus SABA und einer kurzwirkenden anticholinergen Substanz bei Erwachsenen zu empfehlen.
In der systematischen Recherche wurden drei systematische Übersichtsarbeiten identifiziert, die ausschließlich Kinder und Jugendliche betrachteten 25319, 25711, 25874. Eine untersuchte nur Patienten im Krankenhaussetting 25319.
Eine systematische Übersichtsarbeit 25711 evaluierte die Wirksamkeit von Anticholinergika in Kombination mit SABA im Vergleich zu SABA allein in der Initialtherapie des akuten Asthmas bei Kindern ab einem Alter von 18 Monaten. In 19 der 20 eingeschlossenen Studien war Ipratropiumbromid das verwendete Anticholinergikum. In einer Studie mit 44 Teilnehmern wurde Atropin-Sulfat untersucht. Krankenhausaufnahmen aufgrund akuter Exazerbationen waren bei Anwendung der Kombinationstherapie seltener als mit SABA allein (17% vs. 23%, RR 0,73 (95% KI 0,63; 0,85); I² = 0%, 19 RCTs, n = 2 497, Datenqualität hoch). Für ein erneutes Aufsuchen einer Notaufnahme sowie die Nebenwirkung Erbrechen wurden keine signifikanten Unterschiede zwischen den Gruppen identifiziert. Tremor und Übelkeit waren in der Gruppe seltener, die die Kombinationstherapie erhielt. 25711
Eine weitere systematische Übersichtsarbeit 25874 verglich bei Kindern mit akutem Asthma ab zwei Jahren drei Therapien: Anticholinergika allein, SABA allein oder SABA kombiniert mit einem Anticholinergikum. Vier der sechs identifizierten Primärstudien verwendeten Ipratropiumbromid, eine Oxitropiumbromid und eine Atropin. Ein Pooling konnte nur für die Endpunkte Hospitalisierung und Behandlungsversagen erfolgen, da die identifizierten Primärstudien heterogen in der Methodik waren. Im Vergleich der Therapieverfahren trat ein Behandlungsversagen jeweils häufiger auf, wenn das Anticholinergikum allein als Bedarfstherapie angewendet wurde. Die Häufigkeit von Hospitalisierungen unterschied sich nicht signifikant. Die Datenqualität für diese Aussagen ist wegen des häufig hohen Verzerrungsrisikos, der Heterogenität und der fehlenden Präzision als niedrig bis sehr niedrig einzustufen. 25874
Basierend auf dieser eher schwachen Evidenz sieht die Leitliniengruppe eine Indikation für Ipratropiumbromid als Zusatz oder Alternative zu SABA als Bedarfsmedikation für Kinder und Jugendliche nur, wenn Kontraindikationen gegen SABA vorliegen bzw. relevante unerwünschte Wirkungen während der Therapie auftreten (siehe Abbildung 5).
4.7 Initiierung der Langzeittherapie
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Wird ein SABA von erwachsenen Patienten mehr als zweimal wöchentlich angewandt, soll eine antientzündliche Therapie begonnen werden. |
|
|
Bei Kindern und Jugendlichen soll die medikamentöse Langzeittherapie so begonnen und angepasst werden, dass alle Alltagsaktivitäten ohne Bedarfsmedikation möglich sind. |
|
Im klinischen Alltag stellen sich häufig Patienten vor, die einen hohen Verbrauch einer Bedarfsmedikation aufweisen, ohne eine antientzündliche Langzeittherapie zu erhalten. Dieser Zustand spiegelt lediglich eine vermeintliche Symptomkontrolle wider, die ohne eine antientzündliche Therapie das Risiko für akute Exazerbationen erhöht. Bei erwachsenen Patienten empfehlen die Autoren daher, die Langzeittherapie zu beginnen, sobald sie häufiger als zweimal in der Woche ein SABA anwenden (siehe auch Empfehlungen 4-3, 4-4 und 4-5).
Die Auswertung von Routinedaten durch das Zentralinstitut für die kassenärztliche Versorgung 27767 zeigte, dass in den Jahren 2014 und 2015 der überwiegende Anteil (76%) der Patienten mit der Diagnose Asthma und asthmaspezifischer Medikation mindestens einmal im Jahr eine antientzündliche Therapie erhielt. Eine antientzündliche Dauertherapie erhielten aber nur 56% aller Patienten mit entsprechender Medikation. 27767
Die bei Erwachsenen noch akzeptierte regelmäßige zweimal wöchentliche Anwendung eines Bedarfsmedikaments ist nach Einschätzung der Leitliniengruppe bei Kindern und Jugendlichen nicht hinzunehmen. Sie empfehlen die Initiierung der Langzeittherapie bereits früher, nämlich, wenn Kinder und Jugendliche Bedarfsmedikation benötigen, um Alltagsaktivitäten ohne Asthmasymptome zu bewältigen.
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei bisher unbehandelten Patienten mit Kriterien eines teilweise kontrollierten Asthmas sollte die Therapie in der Regel auf Stufe 2 begonnen werden. |
|
|
Bei bisher unbehandelten Patienten mit Kriterien eines unkontrollierten Asthmas sollte die Langzeittherapie mindestens auf Stufe 3 begonnen werden. |
|
Die Empfehlungen 4-20 und 4-21 beruhen auf klinischer Erfahrung. Eine systematische Übersichtsarbeit, die sich explizit mit der Frage beschäftigt, ab welchem Grad der Asthmakontrolle welche Therapiestufe bei bisher unbehandelten Patienten angewandt werden soll, wurde in der systematischen Recherche nicht identifiziert.
Besonderheiten des Erwachsenenalters
Abweichend von der Empfehlung 4-20 macht die Leitliniengruppe auf eine Therapiealternative in begründeten Fällen in Stufe 1 bei Erwachsenen aufmerksam. Während in der 2. Auflage der NVL Asthma in Stufe 1 lediglich eine Bedarfstherapie empfohlen wurde, geht man inzwischen davon aus, dass die auch in Stufe 1 bestehende inflammatorische Komponente des Asthmas durch die Anwendung von niedrigdosierten ICS in Langzeittherapie behandelt werden kann (siehe Abbildung 4).
4.8 Langzeittherapie
4.8.1 Stufe 2 | Alle Altersgruppen
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei erwachsenen Patienten soll in Stufe 2 ein niedrigdosiertes ICS als Langzeittherapie oder die Fixkombination aus ICS niedrigdosiert und Formoterol als Bedarfstherapie angewandt werden. |
|
|
Bei Kindern und Jugendlichen soll in Stufe 2 bevorzugt ein niedrigdosiertes ICS angewandt werden. |
|
|
Die Monotherapie mit Montelukast soll bei Patienten ab einem Alter von 15 Jahren nicht eingesetzt werden, es sei denn die Patienten sind nicht in der Lage, ICS zu inhalieren oder es treten inakzeptable Nebenwirkungen unter ICS auf. |
|
Die Empfehlungen zur Anwendung von ICS niedrigdosiert bei Patienten aller Altersgruppen in Stufe 2 beruhen auf der klinischen Erfahrung der Leitliniengruppe und der identifizierten Evidenz 25875, 25079, 25784. Auch die internationale Leitlinie GINA empfiehlt in der Auflage 2019 diese Therapiestrategie als Option in Stufe 2 29915. Die Empfehlung 4-24 wurde auf Basis der identifizierten systematischen Übersichtsarbeiten 25875, 25323 und der klinischen Erfahrung der Autoren erarbeitet. Für das neue Therapiekonzept der ausschließlich bedarfsorientierten Anwendung der Fixkombination aus ICS niedrigdosiert und Formoterol in Stufe 2 wurde eine systematische Recherche nach randomisiert kontrollierten Studien durchgeführt.
4.8.1.1 Monotherapie
In der systematischen Recherche wurde keine aktuelle Übersichtsarbeit gefunden, die die ICS-Monotherapie mit Placebo vergleicht. Ein systematischer Review 25875, der ICS mit Leukotrienrezeptorantagonisten (LTRA) – jeweils in Monotherapie – verglich, zeigte für die Anwendung von LTRA ein erhöhtes relatives Risiko für Exazerbationen bei Kindern (RR 1,35 (95% KI 0,99; 1,86); I² = 43%, n = 1 662, Datenqualität moderat) und bei Erwachsenen (RR 1,61 (95% KI 1,12; 2,31); I² = 41%, n = 4 415, Datenqualität moderat). Auch für die Endpunkte Symptome tagsüber, Lebensqualität und Asthmakontrolltage war die ICS-Monotherapie der LTRA-Monotherapie zu den meisten Evaluationszeitpunkten überlegen. Lediglich für den Endpunkt Symptome tagsüber wurde in den ersten 36 bis 52 Wochen in zwei pädiatrischen Studien kein signifikanter Unterschied im Gruppenverglich gefunden (SMD 0,16 (95% KI ‑0,02; 0,34); I² = 17%, 2 RCTs, n = 582, Datenqualität niedrig). Auch die unerwünschten Arzneimittelwirkungen unterschieden sich nicht (RR 1,00 (95% KI 0,95; 1,05); I² = 21%, 22 RCTs, n = 7 818, Datenqualität moderat). 25875
Eine systematische Übersichtsarbeit 25323 verglich Montelukast als Monotherapie mit Placebo bei Erwachsenen mit chronischem Asthma. Das Risiko für Exazerbationen war unter Montelukast geringer (OR 0,54 (95% KI 0,39; 0,74); NNT 13 (95% KI 8; 29); 3 RCTs, n = 1 343, Datenqualität moderat). Die Inzidenz unerwünschter Wirkungen war ähnlich. 25323
In einer Drug Safety Mail wird darauf hingewiesen, dass bei Anwendung von Montelukast neuropsychiatrische Symptome – unter Umständen auch erst verzögert – auftreten können 29916. Aufgetreten seien z. B. Schlafstörungen, Depression und Agitiertheit (Häufigkeit: gelegentlich), Störungen von Aufmerksamkeit und Gedächtnis (selten), Halluzinationen und Suizidalität sowie Sprechstörungen (sehr selten). Stottern wurde vor allem bei Kindern unter fünf Jahren und kurz nach Beginn der Behandlung beschrieben. Darüber hinaus wurden Zwangssymptome – in der Regel nach längerer Behandlungsdauer – berichtet. 29916
Basierend auf diesen Ergebnissen sieht die Leitliniengruppe für alle Altersgruppen eine Überlegenheit der ICS-Monotherapie gegenüber Leukotrienrezeptorantagonisten. Bei Patienten ab einem Alter von 15 Jahren wird für die LTRA-Monotherapie eine starke Negativ-Empfehlung ausgesprochen. Diese stellt nur eine nachrangige Therapiealternative in begründeten Fällen dar, wenn Kontraindikationen gegen ICS vorliegen oder schwere unerwünschte Wirkungen unter der Therapie mit ICS auftreten.
Die Routinedatenauswertung durch das Zentralinstitut für die kassenärztliche Versorgung ergab, dass nur wenige Patienten über 15 Jahre (0,17%) eine Monotherapie mit Montelukast erhielten 27767.
Ergänzend wurden zwei systematische Übersichtsarbeiten identifiziert, die eine intermittierende Anwendung von ICS bei persistierendem Asthma analysieren 25079, 25784.
Chong et al. 25079 untersuchten die Wirksamkeit und Sicherheit der intermittierenden Anwendung von ICS im Vergleich zu Placebo. Die intermittierende Nutzung von ICS führte bei der Diagnose eines milden persistierenden Asthmas bei älteren Kindern (OR 0,57 (95% KI 0,29; 1,12); 1 RCT, n = 145, Datenqualität niedrig) und Erwachsenen (OR 0,10 (95% KI 0,01; 1,95); 1 RCT, n = 240, Datenqualität niedrig) zu einer nicht signifikanten Reduktion des Risikos, eine oder mehrere Exazerbationen zu erleiden, die OCS erfordern. Das Risiko verminderte sich nur bei Vorschulkindern mit "Wheezing episodes" signifikant (OR 0,48 (95% KI 0,31; 0,73); n = 490, Datenqualität moderat). Hinsichtlich schwerer unerwünschter Effekte gab es keine signifikanten Unterschiede bei gemeinsamer Auswertung von Jugendlichen und Erwachsenen (OR 1,00 (95% KI 0,14; 7,25); I² = 0%, 2 RCTs, n = 385). Bezüglich des Auftretens von Symptomen, unerwünschten Wirkungen und Hospitalisierungen kann anhand der vorliegenden Evidenz keine Aussage getroffen werden. 25079
Chauhan et al. 25784 verglichen in einer systematischen Übersichtsarbeit eine tägliche mit einer intermittierenden, bzw. bedarfsweisen ICS-Anwendung bei Kindern und Erwachsenen. Weder die Anzahl der Patienten mit einer oder mehreren Exazerbationen, die die Gabe von OCS erforderten (OR 1,07 (95% KI 0,87; 1,32); 7 RCTs, n = 1 204, Datenqualität niedrig) noch das Risiko für das Auftreten schwerer unerwünschter Effekte (OR 0,10 (95% KI 0,33; 2,03); 6 RCTs, n = 1 055, Datenqualität niedrig) unterschied sich signifikant im Gruppenvergleich. Ein Vorteil der kontinuierlichen ICS-Gabe zeigte sich hinsichtlich des Anteils symptomfreier Tage (SMD -0,15 (95% KI ‑0,28; ‑0,03); I² = 0%, n = 984, Datenqualität moderat) und des Unterschiedes der Asthmakontrolltage von Therapiebeginn bis zur Endpunktevaluation (MD -7% Tage (95% KI -14%; -1%); I² = 0%, n = 214, Datenqualität moderat). Ein signifikanter Unterschied zugunsten der Anwendung intermittierender ICS ergab sich bei der Betrachtung der Größenentwicklung nach 44 bis 52 Wochen (MD 0,41 cm (95% KI 0,13; 0,69); I² = 0%, 4 RCTs, n = 532, Datenqualität moderat). 25784
Die Leitliniengruppe empfiehlt eine niedrig dosierte kontinuierliche ICS-Anwendung in Stufe 2, um das Ziel einer kontinuierlichen antiinflammatorischen Wirkung zu erreichen. Sie bewerten die Datenqualität der durchgeführten Studien als zu gering, um die Gleichwertigkeit einer intermittierenden Gabe zu zeigen.
4.8.1.2 Fixkombination aus ICS niedrigdosiert und Formoterol: bedarfsorientiert in Stufe 2
In der systematischen Recherche wurden zwei Nichtunterlegenheitsstudien 28091, 28092 identifiziert, die die ausschließlich bedarfsorientierte Anwendung der Fixkombination aus niedrigdosiertem Budesonid plus Formoterol bei Patienten untersuchten, die eine Behandlung entsprechend der GINA-Stufe 2 benötigten. Patienten mit mildem Asthma ab 12 Jahren wurden über einen Zeitraum von 52 Wochen untersucht 28091, 28092. Ein in der systematischen Recherche identifiziertes Studienprotokoll wurde im Nachgang als Vollpublikation veröffentlicht 29792 und in die Evidenzsynthese eingeschlossen.
Der RCT SYGMA I 28091 prüfte unter anderem die Nichtunterlegenheit der bedarfsorientierten Anwendung der Fixkombination gegenüber der freien Kombination aus Budesonid (Langzeittherapie) plus Terbutalin (Bedarfstherapie) bei 2 559 Patienten. Die Grenze wurde prädefiniert (≥ 0,8 für die untere Grenze des zweiseitigen Konfidenzintervalles). Die Nichtunterlegenheit der bedarfsorienierten Fixkombination gegenüber der freien Kombination aus Budesonid plus Terbutalin hinsichtlich des Endpunktes "well controlled asthma weeks" wurde in der Studie nicht erreicht (34,4% vs. 44,4%; OR 0,64 (95% KI 0,57; 0,73)). Die jährliche Exazerbationsrate unterschied sich im Vergleich der Gruppen nicht signifikant. Die mediane tägliche ICS-Dosis war in der Gruppe, die die Fixkombination erhielt, niedriger (57 µg vs. 340 µg). Unerwünschte Effekte traten ähnlich häufig auf (Fixkombination: 38,0% vs. freie Kombination: 39,9%). 28091 Das Risiko für Attrition und Reporting Bias wird als hoch eingestuft, da keine Intention-to-treat-Analyse (ITT) durchgeführt wurde und die Ergebnisse anders berichtet wurden, als im Protokoll zur Studie geplant.
Der RCT SYGMA II 28092 prüfte bei 4 176 Patienten eine Nicht-Unterlegenheit der bedarfsorientierten Anwendung der o. g. Fixkombination gegenüber der freien Kombination aus Budesonid (Langzeittherapie) plus Terbutalin (Bedarfstherapie) für den primären Endpunkt "jährliche Rate schwerer Exazerbationen". Die Grenze wurde prädefiniert (< 1,2 für die obere Grenze des einseitigen Konfidenzintervalles). Die jährliche Rate schwerer Exazerbationen war in der Interventionsgruppe (Fixkombination) ähnlich häufig wie in der Kontrollgruppe (freie Kombination) (0,11 (95% KI 0,10; 0,13) vs. 0,12 (95% KI 0,10; 0,14)). Damit ist die prädefinierte Nicht-Unterlegenheit erfüllt (relative Risk Ratio 0,97 (einseitige obere 95%-Konfidenzgrenze: 1,16)). Die Asthmakontrolle verschlechterte sich in beiden Gruppen, wobei die Verschlechterung in der Gruppe der mit der Fixkombination behandelten Patienten geringer ausfiel (MD 0,11 units (95% KI 0,07; 0,15)). Die mediane tägliche ICS-Dosis war unter der bedarfsorientierten Fixkombination niedriger als in der Kontrollgruppe (66 µg vs. 267 μg). Unerwünschte Wirkungen traten in beiden Gruppen ähnlich häufig auf. In beiden Gruppen gab es einen Todesfall, wobei der in der Gruppe der freien Kombination als asthmabezogen klassifiziert wurde. 28092 Auch in dieser Studie wurde keine ITT-Analyse durchgeführt. Zudem wurde die Auswertung der Studie während des Verlaufes modifiziert: Der ursprünglich geplante Nachweis der Überlegenheit der Fixkombination wurde in eine Nicht-Unterlegenheitsprüfung geändert. Damit wird ein hohes Risiko für Attrition und Reporting Bias gesehen.
Die Studie PRACTICAL 29792 verglich über 52 Wochen in einem nicht verblindeten randomisiert kontrollierten Design die Wirksamkeit und Sicherheit der bedarfsorientierten Fixkombination (Budesonid plus Formoterol) mit der freien Kombination aus Budesonid (Langzeittherapie) und Terbutalin (Bedarfstherapie). Eingeschlossen wurden Patienten ab 18 Jahren, die in den 12 Wochen vor Studienbeginn ein SABA als Bedarfstherapie inhalierten. 70% der Patienten erhielten darüber hinaus ein ICS in geringer oder mittlerer Dosis als Langzeittherapie vor Beginn der Studie. Die absolute Rate schwerer Exazerbationen war in der Gruppe, die die Fixkombination anwendete, niedriger. Das Konfidenzintervall für die relative Rate schnitt jedoch den Nullwert (absolute Rate pro Patient pro Jahr 0,119 vs. 0,172; relative Rate 0,69 (95% KI 0,48; 1,00)). Die Anzahl der Patienten mit mindestens einem unerwünschten Ereignis war in der Gruppe der Fixkombination etwas höher (385 (88%) vs. 371 (83%)). 29792
Für erwachsene Patienten sehen die Autoren der Leitlinie in der bedarfsorientierten Anwendung einer Fixkombination aus ICS niedrigdosiert und Formoterol in Stufe 2 eine Therapieoption, wenn der mit einer regelmäßigen Therapie verbundenen Aufwand höher bewertet wird als eine maximale Symptomkontrolle. Zu der Entscheidung haben die Nichtunterlegenheit der Fixkombination gegenüber der freien Kombination für den primären Endpunkt in der Studie SYGMA II und die Einsparungen in der täglichen ICS-Dosis beigetragen. Bei der bedarfsorientierten Anwendung der Fixkombination ist es wichtig, die jeweilige Tageshöchstdosis des ICS bzw. des Formoterols nicht zu überschreiten.
In den Studien wurden keine Subgruppenanalysen für die Altersgruppen identifiziert. In SYGMA I waren 12,5% und in SYGMA II 9,9% der eingeschlossenen Patienten im Alter zwischen 12 und 18 Jahren 28091, 28092. Die Leitliniengruppe nutzt die Ergebnisse der Studien daher als indirekte Evidenz. Sie sieht bei Jugendlichen insbesondere ein Problem mit fehlender Adhärenz zur Langzeittherapie und schätzt die bedarfsorientierte Anwendung der Fixkombination daher als mögliche Alternative in solchen begründeten Fällen zum Schutz vor zukünftigen Exazerbationen (siehe Abbildung 5).
Hinweis zum Off-Label-Use
Empfehlungen oder Angaben, die möglicherweise Off-Label-Use beinhalten, sind in der NVL nicht gesondert gekennzeichnet. Da es sich bei der ausschließlich bedarfsorientierten Anwendung von ICS niedrigdosiert und Formoterol in Stufe 2 jedoch um ein neues Therapiekonzept handelt, weist die Leitliniengruppe an dieser Stelle als Ausnahme darauf hin, dass zum Zeitpunkt der Aktualisierung der NVL Asthma zur 4. Auflage keine Zulassungserweiterung für diese Indikation in Deutschland oder im EU-Ausland identifiziert wurde (siehe Kapitel 4.2 Hinweis zum Off-Label-Use).
4.8.1.3 Sicherheitsaspekte im Kindes- und Jugendalter
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei Kindern und Jugendlichen, die Corticosteroide erhalten, sollen folgende Maßnahmen berücksichtigt werden:
|
|
In der systematischen Recherche wurden mehrere systematische Übersichtsarbeiten identifiziert, die die unerwünschten Wirkungen von ICS untersuchten.
Chong et al. 25079 verglichen das Risiko für schwere unerwünschte Wirkungen bei einer intermittierenden ICS-Anwendung mit Placebo altersspezifisch. Vorschulkinder wiesen bei intermittierender Gabe seltener schwere unerwünschte Wirkungen auf, während sich bei fünf- bis 18-jährigen Kindern keine signifikanten Unterschiede im Risiko für schwere unerwünschte Wirkungen im Gruppenvergleich zeigten. 25079
Die Auswirkungen einer ICS-Anwendung auf die Wachstumsgeschwindigkeit und den Größenunterschied nach einem definierten Zeitraum untersuchten die Autoren von vier systematischen Übersichtsarbeiten 25322, 25321, 25784, 25079.
Während die intermittierende Anwendung von ICS die Größenentwicklung im Vergleich zu Placebo noch nicht signifikant beeinflusste 25079, ergaben sich Hinweise, dass Patienten bei zwölfmonatiger täglicher ICS-Anwendung weniger gewachsen sind als unter Placebo (MD -0,61 cm (95% KI -0,83; -0,38); I² = 63%, 15 RCTs, n = 3 314, Datenqualität moderat) 25322. Die Wachstumsgeschwindigkeit war nach einer zwölfmonatigen Anwendung noch vermindert, während nach zweijähriger Anwendung keine signifikanten Unterschiede mehr erkennbar waren 25322. Der Vergleich zwischen intermittierender und täglicher ICS-Anwendung ergab, dass Patienten bei täglicher Gabe nach 44 bis 52 Wochen weniger gewachsen sind als bei intermittierender Gabe (MD 0,41 cm (95% KI 0,13; 0,69); I² = 0%, 4 RCTs, n = 532, Datenqualität moderat) 25784.
Den Einfluss der Dosis des ICS auf die Wachstumsgeschwindigkeit und den Größenunterschied nach 12 Monaten untersuchten Pruteanu et al. 25321. Die Gruppe mit niedrig dosierter ICS-Gabe hatte eine etwas höhere Wachstumsgeschwindigkeit (5,94 cm/y) innerhalb von 12 Monaten als die Gruppe mit höheren ICS-Dosierungen (5,74 cm/y); (MD 0,20 cm/y (95% KI 0,02; 0,39); I² = 0%, 4 RCTs, n = 728, Datenqualität hoch). Der Größenunterschied nach zwölfmonatiger ICS-Anwendung unterschied sich hingegen nicht signifikant. 25321
Eine systematische Übersichtsarbeit, in der sowohl RCTs als auch Beobachtungsstudien betrachtet wurden, errechnete, dass die zwölfmonatige Anwendung von ICS weder bei Kindern noch Erwachsenen mit einem erhöhten Risiko für eine verminderte Knochendichte oder für Frakturen assoziiert war 25149.
Es wurden keine systematischen Übersichtsarbeiten in der Recherche identifiziert, die die unerwünschten Wirkungen einer Langzeitanwendung von OCS betrachten. Da bereits die Anwendung von ICS in hohen Dosierungen bei Kindern und Jugendlichen mit systemischen Nebenwirkungen einhergehen kann, verweisen die Autoren für beide Anwendungsformen auf die in Empfehlung 4-25 genannten Maßnahmen.
Um systemische Nebenwirkungen bei Kindern und Jugendlichen zu verhindern bzw. so gut wie möglich zu minimieren, empfehlen die Autoren, die Anwendung eines Corticosteroids in der niedrigsten noch wirksamen Dosierung. Die wichtigsten Parameter zur Identifizierung relevanter unerwünschter Wirkungen sind in Empfehlung 4-25 aufgelistet.
4.8.2 Stufe 3 | Erwachsene
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei Erwachsenen soll in Stufe 3 als Langzeittherapie bevorzugt eine Kombination aus einem niedrigdosierten ICS und einem langwirksamen Beta-2-Sympathomimetikum (LABA) eingesetzt werden. Alternativ soll ein ICS in mittlerer Dosis eingesetzt werden. |
|
In der systematischen Recherche wurden mehrere systematische Reviews identifiziert, die die Kombinationstherapie eines ICS mit einem langwirksamen Beta-2-Sympathomimetikum (LABA) im Vergleich zur ICS-Monotherapie evaluieren 25901, 25902, 25910.
Ducharme et al. 25901 verglichen die Kombination von ICS plus LABA mit einer ICS-Monotherapie in ähnlicher ICS-Dosierung bei Kindern und Erwachsenen, die zuvor über einen Zeitraum von mindestens vier Wochen ICS erhielten. Die Subgruppenanalysen für den primären Endpunkt wurden entweder für die ICS-Dosis oder für das Alter der untersuchten Patienten durchgeführt. Für erwachsene Patienten war das relative Risiko, eine Exazerbation zu erleiden, die eine Behandlung mit OCS benötigte, bei Erhalt der Kombinationstherapie gesenkt (RR 0,77 (95% KI 0,68; 0,88); I² = 0%, 24 RCTs, n = 6 203; Datenqualität hoch). Für die niedrige ICS-Dosierung wurde eine Peto Odds ratio (POR) 0,63 (95% KI 0,51; 0,78) zugunsten der Kombinationstherapie errechnet. Alle weiteren berichteten Endpunkte wurden für Kinder und Erwachsene gemeinsam und nicht spezifisch für die ICS-Dosierungen ausgewertet. Weder für Exazerbationen, die eine Hospitalisierung erforderten noch für schwere unerwünschte Wirkungen oder jegliche unerwünschte Wirkungen ergab sich ein signifikanter Unterschied. Die Kombinationsbehandlung von LABA plus ICS reduzierte im Vergleich zur ICS-Monotherapie in ähnlicher Dosierung die Symptome tagsüber (SMD -0,33 (95% KI -0,42; -0,23); I² = 0%, 8 RCTs, n = 1 713, Datenqualität moderat), die nächtlichen Symptome (SMD -0,22 (95% KI -0,33; -0,11); I² = 0%, n = 1 319, 5 RCTs, Datenqualität moderat) und verbesserte die Lebensqualität der Patienten (WMD 0,26 (95% KI 0,04; 0,47); I² = 66%, 3 RCTs, Datenqualität niedrig). 25901
In einem weiteren Cochrane-Review untersuchten Ducharme et al. 25902 die Kombination von ICS plus LABA im Vergleich zur ICS-Monotherapie in höherer Dosierung. Das Hinzufügen eines LABA zur bestehenden niedrigdosierten ICS-Therapie führte im Vergleich zur Erhöhung der ICS-Monotherapie zur Senkung des relativen Risikos für Exazerbationen, die eine Behandlung mit OCS erforderten (RR 0,86 (95% KI 0,77; 0,97); I² = 0%, 22 RCTs, n = 9 388, Datenqualität hoch). Dieses Ergebnis entstammt einer Subgruppenanalyse, bei der in 20 der 22 eingeschlossenen Primärstudien erwachsene Patienten betrachtet wurden. Weitere Endpunkte wurden für Kinder und Erwachsene gemeinsam ausgewertet. Die Symptome wurden in den Primärstudien auf unterschiedliche Weise erfasst und zeigten heterogene Ergebnisse. Hinsichtlich der Lebensqualität, dem Risiko für schwere unerwünschte Wirkungen (RR 1,12 (95% KI 0,91; 1,37); I² = 0%, 35 RCTs, n = 13 640, Datenqualität hoch) sowie für jegliche unerwünschte Wirkungen, unerwünschte kardiovaskuläre Wirkungen (z. B. Tachykardien) und Heiserkeit unterschieden sich die Gruppen nicht. 25902
Ni Chroinin et al. 25910 untersuchten, ob eine Kombinationstherapie aus ICS plus LABA bereits bei steroidnaiven Patienten empfohlen werden kann, oder ob zunächst eine ICS-Monotherapie erfolgt sein sollte. Steroidnaive Patienten, die eine höhere Dosis ICS in der Monotherapie erhielten, hatten ein geringeres Risiko für Exazerbationen, die systemische Corticosteroide erforderten, als Patienten, die eine Kombination aus LABA plus ICS in niedrigerer Dosis erhielten (RR 1,24 (95% KI 1,00; 1,53); I² = 0%, 3 RCTs, n = 2 709, Datenqualität hoch). In diese Metaanalyse wurden nur Patienten mit einer Basis-FEV1 ≥ 80% des Sollwertes eingeschlossen. Das relative Risiko für schwere unerwünschte Wirkungen blieb ohne signifikanten Unterschied (RR 1,03 (95% KI 0,63; 1,69); I² = 0%, 4 RTCs, n = 2 864, Datenqualität moderat). 25910
Sicherheit
Zwei systematische Reviews fokussieren auf Sicherheitsaspekte. Sie betrachten jeweils die Kombination von ICS mit Formoterol 25731 und Salmeterol 25767. Zudem liegen die ersten Ergebnisse der von der FDA eingeforderten RCTs zur Sicherheit der Kombinationstherapie aus ICS und LABA vor 26107, 26109, 26108.
Schwere asthmabedingte nicht-tödliche Ereignisse traten bei der Kombinationstherapie aus ICS und Formoterol (0,3%) bei Erwachsenen seltener auf als bei der ICS-Monotherapie in ähnlicher Dosis (0,7%), (Peto OR 0,49 (95% KI 0,28; 0,88); I² = 0, RD = -0,0034 (95% KI -0,0067; -0,0001); 21 Studien, n = 10 208, Datenqualität niedrig) 25731. Mortalität jeglicher Ursache und nicht-tödliche schwere unerwünschte Effekte jeglicher Ursache waren in beiden Gruppen ähnlich 25731.
Für die Kombinationstherapie aus Salmeterol und ICS errechneten sich im Vergleich zur ICS-Monotherapie in ähnlicher Dosierung bei Erwachsenen für keinen der prädefinierten Endpunkte (Mortalität jeglicher Ursache, nicht-tödliche schwere unerwünschte Wirkungen jeglicher Ursache, asthmabedingte nicht-tödliche schwere unerwünschte Wirkungen) signifikante Unterschiede im Gruppenvergleich 25767.
Im direkten Vergleich der Kombinationstherapien aus Fluticason und Salmeterol zu Budesonid und Formoterol waren in einer systematischen Übersichtsarbeit keine signifikanten Unterschiede bezüglich der Endpunkte Mortalität jeglicher Ursache, nicht-tödliche schwere unerwünschte Wirkungen jeglicher Ursache oder asthmabedingte nicht-tödliche schwere unerwünschte Wirkungen erkennbar 17991.
Die in der systematischen Recherche identifizierte systematische Übersichtsarbeit von Hernandez et al. evaluierte die Sicherheit der Kombinationstherapie von ICS und LABA mit Hilfe von Beobachtungsstudien: Die Kombinationstherapie war nicht mit einem höheren Risiko für schwere unerwünschte Effekte assoziiert 25522.
Für die Evaluation der Sicherheit einer Fixkombination aus LABA und ICS im Vergleich zur ICS-Monotherapie in gleicher Dosierung forderte die FDA die Hersteller auf, RCTs durchzuführen 26922. Erste Studienergebnisse lagen vor. Die Studien hatten eine Dauer von 26 Wochen und waren darauf ausgelegt, die Nichtunterlegenheit der Kombinationstherapie gegenüber der ICS-Monotherapie in gleicher Dosis zu prüfen 26107, 26109, 26108, 26711.
Peters et al. 26107 untersuchten die Kombinationstherapie von Formoterol und Budesonid im Vergleich zu Budesonid allein bei 11 693 Patienten ab einem Alter von 12 Jahren. In der Ereignis-Zeit-Analyse für den kombinierten Endpunkt aus Tod, Hospitalisierung und Intubation wurde eine Nichtunterlegenheit für die Kombinationstherapie errechnet (HR 1,07 (95% KI 0,70; 1,65)). Die Wahrscheinlichkeit für das Eintreten von Exazerbationen war bei Erhalt der Kombinationstherapie niedriger (9,2%) als unter ICS-Monotherapie (10,8%), (HR 0,84 (95% KI 0,74; 0,94)). 26107 Dabei blieb unklar, ob die Ergebnisevaluation verblindet erfolgte.
Die Kombinationstherapie aus Salmeterol plus Fluticason wurde bei 11 751 Patienten ab 12 Jahren von Stempel et al. 26109 im Vergleich zu Fluticason allein evaluiert. Auch hier konnte die Nichtunterlegenheit der Kombinationstherapie hinsichtlich schwerer asthmabezogener Ereignisse errechnet werden (HR 1,03 (95% KI 0,64; 1,66). Die Wahrscheinlichkeit für das Auftreten von einer oder mehreren Exazerbationen war bei der Kombinationstherapie (8%) geringer als in der Kontrollgruppe (10%) (HR 0,79 (95% KI 0,70; 0,89)). 26109 Als limitierend wird angesehen, dass die Verblindung von Studienteilnehmern, Personal und der Ergebnisevaluation unklar bleibt und keine Intention-to-treat-Analyse (ITT-Analyse) durchgeführt wurde.
Die Studie zur Kombinationstherapie aus Formoterol plus Fluticason im Vergleich zu Fluticason allein lag zum Zeitpunkt der Recherchen noch nicht als Vollpublikation vor 26711. Die Studienqualität kann daher noch nicht bewertet werden. Die Ergebnisse wurden aus der Datenbank ClinicalTrials.gov extrahiert. Randomisiert wurden 820 Patienten ab einem Alter von 12 Jahren. Asthmabezogene Hospitalisierungen traten in den Gruppen ähnlich häufig auf. 26711
Im Dezember 2017 führte die FDA eine Metanalyse der drei Primärstudien durch, die Jugendliche und Erwachsene einschlossen: Diese ergab, dass das Risiko für schwere asthmabezogene Ereignisse unter der Fixkombination aus ICS plus LABA nicht höher war als unter der ICS-Monotherapie in gleicher Dosierung (HR 1,10 (95% KI 0,85; 1,44)) 27787.
Basierend auf dieser Evidenz empfiehlt die Leitliniengruppe die Kombinationstherapie aus einem niedrigdosierten ICS mit einem LABA und die mitteldosierte ICS-Monotherapie mit starkem Empfehlungsgrad. Für die Bevorzugung der Kombinationstherapie spricht aus Sicht der Leitliniengruppe unter anderem die Möglichkeit der Reduktion von unerwünschten systemischen Wirkungen durch die Anwendung von ICS im niedrigen Dosisbereich.
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Wird eine Kombination aus ICS und LABA angewendet, soll diese in Form einer Fixkombination erfolgen. |
|
Die Empfehlung beruht auf klinischer Einschätzung der Experten. Eine systematische Übersichtsarbeit, die die freie Kombination von ICS und LABA mit einer Fixkombination in ähnlicher Dosierung vergleicht, konnte in der systematischen Recherche nicht identifiziert werden.
Das Zentralinstitut für die kassenärztliche Versorgung analysierte die Häufigkeit einer Monotherapie mit LABA mit Hilfe von Routinedaten 27767. Ausgeschlossen wurden u. a. Patienten, für die im Analysejahr zusätzlich die Diagnose COPD kodiert wurde. 28,2% der verbleibenden Patienten mit der Diagnose Asthma erhielten zumindest zeitweise eine Monotherapie mit einem LABA 27767.
Bei der Verwendung von zwei separaten Inhalationsgeräten für die Langzeittherapie sieht die Leitliniengruppe bei Patienten häufig die Gefahr von Schwierigkeiten in der Handhabung der zwei Inhalationssysteme. Zudem besteht das Risiko einer LABA-Monotherapie bei getrennter Verordnung. Ursachen hierfür können die Angst vor unerwünschten Wirkungen durch ICS und die Symptomverbesserung bereits bei alleiniger Inhalation eines LABA sein (siehe Patientenblatt "Asthma: Behandlung mit Kortison-Spray" unter Patientenblätter bzw. abrufbar unter www.asthma.versorgungsleitlinien.de)). Die sich durch die LABA-Monotherapie ergebenden Sicherheitsrisiken sind im Hintergrundtext der Empfehlung 4-6 aufgeführt. Die Fixkombination bietet den Vorteil, dass die Anwender nicht auf die Inhalation des ICS verzichten können.
Alternativen in begründeten Fällen in Stufe 3 bei Erwachsenen
Neben den in Empfehlung 4-26 genannten Therapieoptionen nennt das Stufenschema zwei weitere Kombinationstherapien in Stufe 3 – einerseits die Kombination aus einem niedrigdosierten ICS mit einem langwirksamen Anticholinergikum (LAMA), andererseits die Kombination eines niedrigdosierten ICS mit einem LTRA. Diese werden jedoch nur in begründeten Ausnahmefällen empfohlen, nämlich, wenn Kontraindikationen gegen LABA bestehen oder wenn während der Therapie mit diesen unerwünschte Arzneimittelwirkungen auftreten.
Zwei systematische Übersichtsarbeiten evaluierten die Kombinationstherapie aus ICS plus LAMA – eine im Vergleich zu einer höher dosierten ICS-Monotherapie 25095 und eine im Vergleich zur Kombinationstherapie aus ICS plus LABA 25130.
Im Vergleich zur höher dosierten ICS-Monotherapie wiesen Patienten mit einer Kombinationstherapie aus ICS plus LAMA eine leicht verbesserte Asthmakontrolle zum Ausgangswert auf (MD -0,18 (95% KI -0,34; -0,02); 1 RCT, n = 210), allerdings ohne klinische Relevanz 25095. Für die weiteren Endpunkte, wie Exazerbationen, die OCS erforderten, Lebensqualität und schwere unerwünschten Wirkungen, ergaben sich keine signifikanten Unterschiede im Gruppenvergleich 25095.
Im Vergleich von ICS plus LAMA mit ICS plus LABA errechneten sich für die meisten patientenrelevanten Endpunkte (Exazerbationen, die eine Behandlung mit OCS erfordern, schwere unerwünschte Wirkungen sowie jegliche unerwünschte Wirkungen) keine signifikanten Unterschiede 25130. Für die Endpunkte Lebensqualität (4 RCTs, Datenqualität hoch) und Asthmakontrolle (3 RCTs, Datenqualität hoch) erwies sich die Kombination aus ICS plus LABA als vorteilhaft, ohne dabei eine klinische Relevanz zu erreichen 25130. Da Primärstudien mit verschiedenen ICS-Dosierungen eingeschlossen wurden, ist die Aussagekraft der Daten eingeschränkt.
Ein Cochrane-Review 25388 verglich ICS plus LTRA mit ICS plus LABA. Die Auswertungen können nur indirekt herangezogen werden, weil sie entweder spezifisch für die Altersgruppe oder für die ICS-Dosierung durchgeführt wurden. Bei Erwachsenen war das relative Risiko für das Auftreten von Exazerbationen, die systemische Corticosteroide erforderten, bei der Kombinationstherapie von ICS plus LABA (Salmeterol) niedriger als bei der Kombination aus ICS plus LTRA (RR 0,87 (95% KI 0,76; 1,00); I² = 6%, 7 RCTs, n = 5 923, Datenqualität moderat). Eine weitere Auswertung des systematischen Reviews, die den Endpunkt bei Anwendung eines niedrig dosierten ICS gemeinsam bei Kindern und Erwachsenen untersuchte, fand einen Vorteil für die Kombination aus ICS plus LABA (RR 0,81 (95% KI 0,66; 0,98); I² = 41%, 4 RCTs, n = 3 076). Erwachsene Patienten mit ICS plus LABA hatten eine signifikant stärkere Verbesserung der Asthmasymptom-Scores (SMD -0,18 (95% KI -0,25; -0,12); I² = 0%, 5 RCTs, n = 3 823, Datenqualität hoch) und der Lebensqualität (SMD 0,12 (95% KI 0,05; 0,19); I² = 0%, 4 RCTs, n = 3 243, Datenqualität hoch) als solche, die ICS plus LTRA erhielten. 25388 Die klinische Relevanz der Ergebnisse erscheint jedoch eher schwach. Schwere unerwünschte Wirkungen (RR 1,35 (95% KI 1,00; 1,82); n = 5 658 Erwachsene) und jegliche unerwünschte Wirkungen (RR 1,02 (95% KI 0,99; 1,06); n = 5 977 Erwachsene, 300 Kinder) traten im Gruppenvergleich jeweils ähnlich oft auf 25388.
Theophyllin
Die Verordnungen von Theophyllin sind in den letzten Jahren rückläufig 26114. Aus Sicht der Leitliniengruppe hat Theophyllin aufgrund seiner geringen therapeutischen Breite, des Nebenwirkungspotentials und der verfügbaren Alternativen keinen Stellenwert mehr in der Behandlung des Asthmas. Aus diesem Grund wird es nicht mehr in das Stufenschema aufgenommen.
4.8.3 Stufe 3 | Kinder und Jugendliche
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei Kindern und Jugendlichen soll in Stufe 3 die Monotherapie mit einem mitteldosierten ICS empfohlen werden. |
|
In der systematischen Recherche wurde keine systematische Übersichtsarbeit identifiziert, die als direkte Evidenz zur Begründung der Empfehlung 4-28 herangezogen werden kann.
Die Leitliniengruppe entscheidet sich auf Basis der in Stufe 2 und Stufe 4 zitierten Studienergebnisse, in Stufe 3 bei Kindern und Jugendlichen eine Dosiserhöhung der ICS auf mitteldosiert zu empfehlen. Eine Kombination aus niedrigdosierten ICS und LABA stellt für die Autoren keine Therapiealternative in Stufe 3 dar, da angenommen werden kann, dass die Entzündungskontrolle bei dieser Kombination nicht ausreichend ist und sich ein erhöhtes Risiko für Exazerbationen ergibt.
In der von der FDA beauftragten und von Stempel et al. durchgeführten VESTRI-Studie 26108 ergab sich für den Endpunkt asthmabezogene schwere unerwünschte Wirkungen eine Nichtunterlegenheit der Fixkombination aus Salmeterol und Fluticason gegenüber Fluticason allein in gleicher Dosierung für den Kompositendpunkt schwere asthmabezogene Ereignisse (0,9% vs. 0,7%; HR 1,28 (95% KI 0,73; 2,27). Die Wahrscheinlichkeit für das Eintreten von Exazerbationen war unter der Fixkombination niedriger (8,5%) als in der Kontrollgruppe (10,0%) mit einer Ereignis-Zeit-Analyse zugunsten der Fixkombination (HR 0,86 (95% KI 0,73; 1,01)). In anderen Endpunkten zeigte sich eine Tendenz zu besseren Ergebnissen für die ICS-Monotherapie. In der Studie wurden alle Dosierungen gemeinsam ausgewertet, so dass eine spezifische Aussage zur Kombinationstherapie bei niedriger Dosierung nicht getroffen werden kann. 26108 Die Studienqualität wird dadurch beeinträchtigt, dass die Verblindung der Ergebnisevaluation unklar bleibt und keine ITT-Analyse durchgeführt wurde.
4.8.4 Stufe 4 | Erwachsene
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei Erwachsenen soll in Stufe 4 bevorzugt die Kombination aus einem ICS im mittleren oder hohen Dosisbereich und einem LABA angewandt werden. |
|
Die Therapieoptionen der Stufe 4 beruhen auf der klinischen Erfahrung der Leitliniengruppe und den identifizierten systematischen Übersichtsarbeiten.
Die bevorzugte Therapieoption ist ein mittel- bis hochdosiertes ICS in Kombination mit einem LABA. Eine Subgruppenanalyse des Cochrane-Reviews von Ducharme et al. 25901 ergab, dass die Kombinationstherapie aus mitteldosiertem ICS plus LABA der mitteldosierten ICS-Monotherapie hinsichtlich Exazerbationen, die eine Behandlung mit OCS erfordern, überlegen war (POR 0,68 (95% KI 0,48; 0,97); I² = 0%, 6 RCTs, n = 1 076). In einer weiteren Subgruppenanalyse des Reviews, in der die hochdosierte ICS-Monotherapie mit der Kombinationstherapie aus hochdosierten ICS plus LABA verglichen wurde, errechnete sich für den gleichen Endpunkt kein signifikanter Unterschied zwischen den Gruppen (POR 0,94 (95% KI 0,58, 1,54); 7 RCTs, n = 1 366). 25901 Beide Subgruppenanalysen waren nicht nach Altersgruppen differenziert und können daher nur bedingt als Evidenzgrundlage genutzt werden.
Die Subgruppenanalyse eines weiteren Cochrane-Reviews, in der eine Kombination aus einem mitteldosiertem ICS plus LABA mit einer ICS-Monotherapie in höherer Dosierung verglichen wurde, fand keinen signifikanten Unterschied für das Risiko von Exazerbationen, die eine Behandlung mit OCS erforderten 25902.
Eine systematische Übersichtsarbeit 25133 verglich die Kombinationstherapie von ICS plus LABA mit einer Dreifachkombination aus ICS, LABA und langwirksamen Anticholinergika (LAMA). Exazerbationen, die mit OCS behandelt werden mussten, traten bei Patienten, die die Dreifachkombination erhielten, seltener auf (271/1 000 vs. 328/1 000). Der Unterschied war jedoch nicht signifikant (OR 0,76 (95% KI 0,57; 1,02); I² = 1%, 2 RCTs, n = 907, Datenqualität moderat). Ebenfalls nicht signifikant waren die Unterschiede im Gruppenvergleich hinsichtlich der Lebensqualität, der schweren unerwünschten Effekte und der Exazerbationen, die eine Hospitalisierung erforderlich machten. Die Asthmakontrolle, erhoben mit dem Asthma-Control-Questionnaire (ACQ-9), war zugunsten der Dreifachkombination verbessert (MD -0,13 (95% KI ‑0,23; ‑0,02); I² = 0%, n = 907, 2 RCTs, Datenqualität hoch). Zudem waren jegliche unerwünschte Effekte bei Erhalt der Dreifachkombination seltener (OR 0,70 (95% KI 0,52; 0,94); I² = 0%, 3 RCTs, n = 1 197, Datenqualität hoch). 25133
Die Leitliniengruppe sieht eine additive Behandlung mit LAMA zu einer bereits bestehenden Medikation aus ICS in mittlerer oder hoher Dosis plus LABA als Therapiealternative für Patienten mit Asthma in Stufe 4. Wichtig ist, dass in der Stufe 4 alle verfügbaren Therapieoptionen ausgereizt werden, bevor die Therapie zur Stufe 5 eskaliert wird. Dabei entscheidet der Arzt individuell mit dem Patienten (siehe Kapitel 3.2 Gemeinsame Entscheidungsfindung), ob er zunächst die ICS-Dosis erhöht oder zu einer Dreifachkombination übergeht.
Alternative in begründeten Fällen in Stufe 4 bei Erwachsenen
In begründeten Fällen, insbesondere, wenn Kontraindikationen gegen die bisher verwendeten Medikamente vorliegen oder unerwünschte Wirkungen bei deren Anwendung auftreten, empfiehlt die Leitliniengruppe auch die Kombination aus ICS mittel- bis hochdosiert, LABA und LTRA oder ICS mittel- bis hochdosiert und LAMA. In der systematischen Recherche wurden keine Metaanalysen identifiziert, die die Wirksamkeit und Sicherheit der Dreifachkombination evaluierten.
Die Ergebnisse der systematischen Übersichtsarbeiten, die die Kombinationstherapien von ICS plus LAMA im Vergleich zu einer höheren ICS-Dosis 25095 oder im Vergleich zur Kombination aus ICS plus LABA 25130 untersuchten, sind bereits im Hintergrundtext der Therapiealternativen in begründeten Fällen der Stufe 3 zitiert (siehe Kapitel 4.8.2 Stufe 3 | Erwachsene). Diese können auch hier nur indirekt herangezogen werden, weil für die Vergleiche keine Subgruppenanalysen für die verschiedenen ICS-Dosierungen vorgenommen wurden.
4.8.5 Stufe 4 | Kinder und Jugendliche
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei Kindern und Jugendlichen soll in Stufe 4 eine Kombinationstherapie aus einem mitteldosierten ICS mit einem LABA oder/und einem LTRA empfohlen werden. |
|
|
Kinder und Jugendliche, deren Asthma eine Behandlung der Stufe 4 erfordert, sollten zu einem pädiatrischen Pneumologen überwiesen werden. |
|
In der systematischen Recherche wurden drei systematische Übersichtsarbeiten identifiziert, die Interventionen für den Übergang von Stufe 3 zu 4 bei Kindern und Jugendlichen untersuchten:
Chauhan et al. 25074 verglichen in ihrem Cochrane-Review ICS plus LABA mit einer ICS-Monotherapie in ähnlicher Dosierung bei Kindern und Jugendlichen. Eine Subgruppenanalyse für ICS in mittlerer Dosierung errechnete für das Risiko von Exazerbationen, die systemische Corticosteroide erforderten, keinen signifikanten Unterschied im Gruppenvergleich (RR 0,89 (95% KI 0,48; 1,64); n = 270, 3 RCTs, Datenqualität niedrig) 25074. Die weiteren Auswertungen können nur indirekt herangezogen werden, da die verwendeten ICS-Dosierungen nicht spezifiziert wurden. Unterschiede wurden im Hinblick auf die Endpunkte Exazerbationen, die eine Hospitalisierung erfordern, Lebensqualität, jegliche unerwünschte Effekte sowie schwere unerwünschte Effekte zwischen den Gruppen nicht gefunden 25074.
Die Subgruppenanalyse von Ducharme et al. 25901 verglich ICS mitteldosiert plus LABA mit einer ICS-Monotherapie in ähnlicher Dosierung, allerdings ohne nach Altersgruppen zu differenzieren, sodass das Ergebnis nur indirekt genutzt werden kann. Das Risiko für Exazerbationen, die eine Behandlung mit OCS erfordern, war unter der Kombinationstherapie geringer (POR 0,68 (95% KI 0,48; 0,97); I² = 0%, 6 RCTs, n = 1 076, Datenqualität moderat). Eine andere Subgruppenanalyse dieses systematischen Reviews differenzierte zwar nach Altersgruppen, nicht jedoch nach der angewandten ICS-Dosierung. Für Kinder und Jugendliche wurde kein signifikanter Unterschied für das Risiko von Exazerbationen, die eine Behandlung mit OCS erfordern, gefunden (RR 0,88 (95% KI 0,58; 1,39); I² = 0%, 6 RCTs, n = 604; Datenqualität niedrig). 25901
Chauhan et al. erstellten zudem einen Cochrane-Review 25686, der ICS plus LTRA mit einer ICS-Monotherapie in ähnlicher Dosierung bei Kindern mit persistierendem Asthma verglich. Die Dosis des ICS wurde nicht spezifiziert. Das Risiko für mindestens eine Exazerbation, die die Behandlung mit OCS erforderte, unterschied sich nicht signifikant zwischen den Gruppen. 25686
Ein weiterer Cochrane-Review 25388 verglich zwei Therapieoptionen innerhalb der Stufe 4: ICS mitteldosiert plus LABA mit ICS mitteldosiert plus LTRA. Es wurde eine Studie mit 1 452 Patienten ab einem Alter von 15 Jahren eingeschlossen. Hier ergab sich kein signifikanter Unterschied hinsichtlich des Endpunktes Exazerbationen, die eine Behandlung mit systemischen Corticosteroiden erfordern (RR 0,85 (95% KI 0,67; 1,08)). Das Verzerrungsrisiko der Studie ist gering. 25388 Aufgrund der untersuchten Altersgruppe kann sie jedoch nur indirekt für Kinder und Jugendliche herangezogen werden.
Zur Wirksamkeit und Sicherheit der Zusatztherapie mit Tiotropium bei Kindern und Jugendlichen wurde eine systematische Übersichtsarbeit identifiziert 25196, die durch eine systematische Recherche nach RCTs ergänzt wurde. Für Stufe 4 werden die Phase-III-Studien zitiert, die Patienten betrachten, die trotz einer bestehenden Langzeittherapie aus einem mitteldosierten ICS mit oder ohne mindestens einem weiteren Langzeittherapeutikum Symptome aufwiesen. 26592, 26649
Ein RCT 26592 mit 398 Jugendlichen, die ein mitteldosiertes ICS und mit mindestens einem weiteren Langzeittherapeutikum erhielten, verglich die Anwendung von Tiotropium mit der von Placebo über ein Jahr. Vor Beginn der Studienmedikation mussten die Teilnehmer das zuvor verordnete LABA absetzen, während ICS mitteldosiert und LTRA beibehalten werden durften. Die Anzahl der Patienten, die mindestens eine schwere Asthmaexazerbation im Studienzeitraum aufwiesen, betrug 1,5% in der mit 5 µg Tiotropium, 4% in der mit 2,5 µg und 6,5% in der mit Placebo behandelten Gruppe. Der Anteil der Patienten, die eine klinisch relevante Verbesserung im ACQ-6 oder ACQ-7-Score aufwies, unterschied sich nicht signifikant zwischen den Gruppen. Die Inzidenz unerwünschter Wirkungen war in der Placebogruppe am geringsten (2,5 µg: 63,2%; 5 µg: 62,7%; Placebo: 59,4%). Asthmaexazerbationen und die Verschlechterung des Asthmas wurden als sekundärer Endpunkt und als unerwünschte Wirkung erfasst. 26592 Es wird ein Risiko für Reporting Bias gesehen und das Studiendesign hinterfragt, da das Absetzen der zuvor bestehenden Therapie mit LABA bei symptomatischen Patienten einer Therapiereduktion entspricht.
Ein RCT 26649 evaluierte Tiotropium als Zusatztherapie zu mitteldosierten ICS, entweder als Mono- oder Kombinationstherapie mit einem weiteren Langzeittherapeutikum, bei sechs- bis elfjährigen Kindern mit moderatem Asthma über einen Zeitraum von 48 Wochen. Die mittlere Differenz der Lebensqualität, gemessen mit dem Paediatric Asthma Quality of Life Questionnaire (PAQLQ(S)) war nach 24 Wochen in der Gruppe der mit 2,5 µg behandelten Patienten besser als in der Placebogruppe (MD 0,176 (95% KI 0,035; 0,316), wobei die klinische Relevanz unklar bleibt. Alle weiteren Vergleiche bezüglich der Endpunkte Lebensqualität und ACQ-1A-Score ergaben in der Gesamtauswertung keine signifikanten Unterschiede im Vergleich von Placebo zu den einzelnen Dosierungen. Die Rate unerwünschter Wirkungen (Placebo: 60,31%; 2,5 µg: 56,3%; 5 µg: 52,59%) und schwerer unerwünschter Wirkungen (Placebo: 4,58%; 2,5 µg: 2,22%; 5 µg: 0,74%) war in der Placebogruppe höher als in den Interventionsgruppen, am ehesten begründet durch die Häufigkeit der Verschlechterung des Asthmas. 26649 Zum Zeitpunkt der Recherche (05/2018) waren die Ergebnisse nur in der Datenbank ClinicalTrials.gov veröffentlicht, sodass das Verzerrungspotential noch nicht abschließend bewertet werden kann.
Zudem evaluierte die 12 Wochen dauernde Phase-II-Studie von Vrijlandt et al. 27974 Tiotropium in zwei Dosierungen (2,5 µg und 5 µg) als Zusatz zur ICS-Mono- oder Kombinationstherapie mit einem weiteren Langzeitmedikament (LABA oder LTRA) bei 101 Vorschulkindern, die weiterhin Symptome aufwiesen. Die durchschnittliche ICS-Dosis (Budesonid oder Äquivalent) lag im mittleren Dosisbereich (Placebo: 275 µg; 2,5 µg: 228 µg; 5 µg: 264 µg) (siehe Tabelle 7). Die Endpunkte Symptome tagsüber, Symptome nachts und nächtliches Erwachen unterschieden sich für keine der untersuchten Dosierungen signifikant im Vergleich zur Placebogruppe. Unerwünschte Wirkungen (Placebo: 74%; 2,5 µg: 56%; 5 µg: 58%) und schwere unerwünschte Wirkungen (Placebo: 8,82%; 2,5 µg: 0%; 5 µg: 0%) waren in der Placebogruppe häufiger. Die häufigste unerwünschte Wirkung war "Asthma". Dabei handelte es sich um stattgehabte Exazerbationen. 27974 Als Verzerrungsrisiko werden die niedrige Fallzahl und die fehlende Fallzahlkalkulation angesehen. Als Grund wird genannt, dass die Effektgröße für die Studienautoren vorab nicht abschätzbar war.
Die Leitliniengruppe schätzt die Evidenzlage für Stufe 4 insgesamt eher niedrig ein. Keine der Therapieoptionen erbrachte in den identifizierten Metaanalysen einen deutlichen Vorteil. Für die Behandlung von Kindern und Jugendlichen mit Tiotropium standen zum Zeitpunkt der Recherche Studien mit einem Placebovergleich als Add-on zur Verfügung. Sie empfiehlt daher wegen der unerwünschten Wirkungen bei einer höheren ICS-Dosierung (siehe Empfehlung 4-25) zunächst ICS im mittleren Dosisbereich mit den im Stufenschema aufgezeigten Kombinationen anzuwenden.
Die Leitliniengruppe sieht die Vierfach-Kombination mit Tiotropium in Stufe 4 nur dann als Option, wenn Kinder oder Jugendliche unter einer Dreifach-Kombination weiterhin symptomatisch bleiben. Sie empfiehlt diese Eskalation, bevor die ICS-Dosis erhöht wird und damit eine Behandlung in Stufe 5 erfolgt (siehe Empfehlung 4-41). Leitend ist auch hier das Ziel, möglicherweise eine Symptomkontrolle zu erreichen, ohne die ICS-Dosis zu erhöhen.
Auf Basis der klinischen Erfahrung beurteilt sie das Risiko für unerwünschte Wirkungen auch bei den Kombinationstherapien geringer als bei der Aufdosierung des ICS.
Wegen der Schwere der Erkrankung und der als niedrig eingeschätzten Evidenzlage für die Therapiealternativen in Stufe 4 empfiehlt die Leitliniengruppe die Überweisung zum pädiatrischen Pneumologen, damit ein erfahrener Spezialist die Therapieplanung evaluiert.
Fixkombination
Auch für Kinder und Jugendliche gilt die Empfehlung zur Anwendung einer Fixkombination aus ICS und LABA. Ergänzend zur bereits erläuterten Rationale (siehe Empfehlung 4-27), wurde von den Autoren eine Kohortenstudie mit 2 660 Kindern eingebracht: In der Auswertung ergaben sich Hinweise, dass die Wahrscheinlichkeit für den Kompositendpunkt Asthmakontrolle bei Erhalt der freien Kombination geringer war (adjustierte OR 0,77 (95% KI 0,66; 0,91)). 27775
4.8.6 Stufe 5 | Erwachsene
4.8.6.1 Vorbemerkung
Schweres Asthma wird in Kapitel 1 Definition und Epidemiologie definiert. Zur Definition (Eingrenzung/Spezifizierung) des schweren eosinophilen Asthmas wurden zwei von den Autoren eingebrachte Kohortenstudien herangezogen 26788, 26138.
Eine dänische Studie 26788 mit 4 838 beobachteten Patienten ermittelte, dass Patienten mit Asthma einen Median von 220 Eosinophilen/µl Blut aufwiesen. Mehr als 290 Eosinophilen/µl Blut waren mit einem erhöhten Risiko für mittelschwere bis schwere Exazerbationen assoziiert. 26788
Price et al. 26138 errechneten eine Assoziation zwischen einer erhöhten Eosinophilenzahl (> 400/µl Blut) und der Anzahl der Exazerbationen. Diese Ergebnisse wurden anhand einer retrospektiven Kohortenstudie mit 130 248 Patienten ermittelt. Die errechnete Assoziation schwächte sich ab, wenn der Schwellenwert niedriger angesetzt wurde. 26138
Die Leitliniengruppe erachtet einen mindestens zweimaligen Nachweis von mehr als 300 Eosinophilen/µl Blut außerhalb von Exazerbationen und ohne Medikation mit systemischen Corticosteroiden für die Diagnose eines schweren eosinophilen Asthmas bei Patienten mit schwerem Asthma für notwendig. Dabei ist zu berücksichtigen, dass eine Therapie mit systemischen Corticosteroiden die Zahl der eosinophilen Granulozyten im Blut verringern kann.
Es ist wichtig, das schwere eosinophile Asthma differentialdiagnostisch von einem schweren allergischen Asthma mit Eosinophilie abzugrenzen. Charakteristisch für ein schweres allergisches Asthma ist ein kausaler Zusammenhang zwischen einer allergischen Sensibilisierung und typischen Asthmabeschwerden sowie Exazerbationen. Für Patienten mit allergischem Asthma war in einer Post-hoc-Analyse der EXTRA-Studie die Reduktion von Exazerbationen durch die Therapie mit Omalizumab ausgeprägter, wenn die Eosinophilenzahl ≥ 260/µl Blut war 26785.
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei Erwachsenen soll vor der Behandlung in Stufe 5 die Indikation zu einer Rehabilitation geprüft werden. |
|
Diese Empfehlung basiert auf einem Expertenkonsens und den Ergebnissen der EPRA-Studie 30502. Die Ergebnisse sind im Kapitel 11.2 Wirksamkeit der pneumologischen Rehabilitation bei Asthma dargestellt. Eine Rehabilitationsmaßnahme ermöglicht eine engmaschigere Beobachtung der Patienten. Adhärenz und Hürden in der Umsetzung der Therapie können so gemeinsam mit den Patienten ermittelt werden. In Anbetracht der zusätzlichen Risiken, die eine Behandlung in Stufe 5 mit sich bringen kann, ist es wichtig, die Indikation zu einer Rehabilitation zu prüfen und sicherzustellen, dass die Therapie in Stufe 4 optimal umgesetzt wurde, bevor Stufe 5 initiiert wird.
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Die Indikation zur Therapie mit monoklonalen Antikörpern sollte erst gestellt werden, wenn selbst unter dreimonatiger maximaler inhalativer Kombinationstherapie mit einem ICS in Höchstdosis, einem LABA und einem LAMA (Tiotropium) keine Asthmakontrolle erreicht wird. |
|
Die allgemeinen Prinzipien der Intensivierung der Therapie sind in den Empfehlungen 4-8 bis 4-11 dargestellt. Darüber hinaus weist die Leitliniengruppe darauf hin, dass die Therapie mit monoklonalen Antikörpern in Stufe 5 sehr aufwändig und über einen längeren Zeitraum mit hohen Kosten verbunden ist. Vor diesem Hintergrund erachtet sie es auf Basis eines Expertenkonsenses als notwendig, dass die in der Empfehlung 4-33 genannte Dreifachkombination mit ICS höchstdosiert (siehe Tabelle 6) über drei Monate evaluiert wird, bevor die Therapie mit monoklonalen Antikörpern initiiert wird. Der Eindruck aus der Versorgungssituation ist, dass die Kombination ICS plus LABA plus LAMA vor einer weiteren Therapieeskalation häufig nicht ausgeschöpft wird, da es sich um ein eher neueres Therapiekonzept handelt.
4.8.6.2 Omalizumab
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Ein Therapieversuch mit Omalizumab für mindestens vier Monate soll bei Erwachsenen in Stufe 5 empfohlen werden, wenn folgende Kriterien vorliegen:
|
|
In der systematischen Literaturrecherche wurden mehrere systematische Übersichtsarbeiten identifiziert, die die Wirksamkeit und Sicherheit einer Therapie mit Omalizumab untersuchten 25390, 25681, 25195, 25142.
Im Cochrane-Review von Normansell et al. 25390 senkte Omalizumab während der kontinuierlichen Corticosteroidgabe das Risiko für eine oder mehr Exazerbationen im Vergleich zu Placebo (OR 0,55 (95% KI 0,46; 0,65); I² = 50%, 10 RCTs, n = 3 261, moderate Datenqualität) und die Häufigkeit von Hospitalisierungen (OR 0,16 (95% KI 0,06; 0,42); I² = 0%, 4 RCTs, n = 1 824, moderate Datenqualität). Bei schwererer Erkrankung war der Effekt von Omalizumab hinsichtlich der Exazerbationen nicht mehr signifikant 25390.
Während des Ausschleichens von Corticosteroiden waren Exazerbationen unter Omalizumab seltener als unter Placebo (OR 0,49 (95% KI 0,39; 0,62); I² = 23%, 5 RCTs, n = 1 726, Datenqualität moderat) 25390.
Die Daten zur Sicherheit wurden für die steroidstabile und die Ausschleichphase gemeinsam ausgewertet 25390. Schwere unerwünschte Wirkungen waren in der Gruppe der mit Omalizumab behandelten Patienten weniger wahrscheinlich (OR 0,72 (95% KI 0,57; 0,91); I² = 7%, 15 RCTs, n = 5 713, Datenqualität moderat). Hinsichtlich jeglicher unerwünschter Wirkungen und Mortalität ergab sich kein Unterschied. Reaktionen an der Injektionsstelle waren unter Omalizumab höher (OR 1,72 (95% KI 1,33; 2,24); I² = 42%; 9 RCTs, n = 3 577, Datenqualität moderat). 25390
Die gepoolten Auswertungen von Daten aus Studien mit einer Dauer von 52 bis 60 Wochen von Lai et al. zeigten ähnliche Tendenzen für die oben genannten Endpunkte 25142.
Ein HTA-Bericht von Norman et al. 25681 betrachtete neben randomisiert kontrollierten Studien auch die Ergebnisse von prospektiven und retrospektiven Beobachtungsstudien. In den Beobachtungsstudien war für die Endpunkte Exazerbationsraten, Hospitalisierungen und Symptome eine Tendenz zur Verbesserung bei Anwendung von Omalizumab erkennbar 25681.
Die Europäische Arzneimittel-Agentur (EMA) 26761 nennt als häufigste Nebenwirkungen Kopfschmerzen, Reaktionen an der Injektionsstelle und bei Kindern Fieber und Oberbauchbeschwerden. Zudem wird auf das Risiko für anaphylaktische Reaktionen, arterielle thrombembolische Ereignisse, eine Verminderung der Zahl der Blutplättchen, parasitäre Infektionen und das Auftreten eines systemischen Lupus erythematodes hingewiesen 26761.
Das Arznei-Telegramm warnt vor anaphylaktischen Reaktionen, die auch erst mit einer Latenz von Stunden oder Tagen nach Injektion und nicht nur bei der ersten Gabe auftreten können 26755. Weiterhin weist es auf ein erhöhtes Risiko für kardiovaskuläre Nebenwirkungen hin 26754.
Die Leitliniengruppe empfiehlt einen Therapieversuch mit Omalizumab, wenn die in Empfehlung 4-34 genannten eng umschriebenen Kriterien erfüllt sind. Entscheidend ist, vor Initiierung der Therapie alle vermeidbaren Allergene zu eliminieren (siehe Kapitel 6.8 Verminderung der Allergenexposition) und die Möglichkeiten der Tabakentwöhnung vor Therapiebeginn auszuschöpfen (siehe Kapitel 6.5 Tabakentwöhnung). Details der Anwendung monoklonaler Antikörper sind in den Empfehlungen 4-37 bis 4-39 beschrieben.
4.8.6.3 Mepolizumab, Reslizumab und Benralizumab
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Ein Therapieversuch mit Mepolizumab, Reslizumab oder Benralizumab für mindestens vier Monate sollte bei Erwachsenen in Stufe 5 erwogen werden, wenn folgende Kriterien vorliegen:
|
|
In der systematischen Recherche wurde eine systematische Übersichtsarbeit identifiziert, die die Wirksamkeit und Sicherheit einer subkutanen Gabe von Mepolizumab bei Patienten mit Asthma untersuchte 25185. Diese Übersichtsarbeit wurde durch eine systematische Recherche nach randomisiert kontrollierten Studien (RCT) für Mepolizumab und weitere Anti-Interleukin-5-Antikörper ergänzt.
Im Vergleich zu Placebo senkte die subkutanen Gabe von Mepolizumab in einem Studienzeitraum von 32 Wochen (MENSA) die Rate klinisch relevanter Exazerbationen (0,83 vs. 1,74; Rate Ratio 0,47 (95% KI 0,35; 0,63); 1 RCT, n = 385, Datenqualität moderat) und die Anzahl der Exazerbationen, die das Aufsuchen einer Notaufnahme oder eine Hospitalisierung nach sich zogen 25185. Des Weiteren verbesserten sich die Lebensqualität und die Symptome signifikant, letztere allerdings nicht klinisch relevant 25185.
Ein RCT (SIRIUS) 26503 mit 135 Teilnehmern berichtete, dass durch die subkutane Applikation von Mepolizumab über einen Zeitraum von 24 Wochen im Vergleich zu Placebo mehr OCS eingespart werden konnten (OR 2,39 (95% KI 1,25; 4,56)). Auch die jährlich Exazerbationsrate verbesserte sich durch Mepolizumab trotz der OCS-Reduktion (Rate Ratio 0,68 (95% KI 0,47; 0,99) 26503. Die niedrige Fallzahl und die fehlende Verblindung der Ergebnisevaluation stellen allerdings ein Risiko für eine Verzerrung dar.
Reslizumab wurde in zwei identisch designten RCTs bei Patienten im Alter zwischen 12 und 75 Jahren über einen Zeitraum von 48 Wochen untersucht, die gemeinsam auswertet wurden 26500. Klinisch relevante Exazerbationen waren in der Interventionsgruppe seltener als in der Placebogruppe (32% vs. 50%, Rate Ratio 0,46 (95% KI 0,37; 0,58)). Die Lebensqualität, gemessen mit dem Asthma Quality of Life Questionnaire (AQLQ), und die Asthmakontrolle, erfasst mit dem ACQ-7, waren nach 16 und 52 Wochen unter Reslizumab leicht, aber nicht klinisch relevant gebessert. 26500 Die fehlende Verblindung der Ergebnisevaluation stellt auch hier ein Risiko für eine Verzerrung dar.
Die Phase-III-Studie von Corren et al. 26494 prüfte die Abhängigkeit der Wirksamkeit und Sicherheit von Reslizumab von der Eosinophilenzahl im Blut bei 492 Patienten der Altersgruppe von 18 bis 65 Jahren über einen Zeitraum von 16 Wochen. Bei der Ausgangserhebung wiesen 20% der eingeschlossenen Patienten eine Eosinophilenzahl ≥ 400/µl auf. Eine klinisch relevante Verbesserung des sekundären Endpunktes Asthmakontrolle, gemessen mit dem ACQ-7, war unter Reslizumab häufiger als in der Placebogruppe (71% vs. 57%). Je höher die Eosinophilenzahl war, desto deutlicher war die Verbesserung der Asthmakontrolle. Die Fallzahl für diese Subgruppenanalyse war jedoch gering und die Power der Studie genügte nicht, um repräsentative Ergebnisse zu generieren. 26494
Gestützt werden die Aussagen von Corren et al. 26494 durch eine weitere Phase-III-Studie 26493, bei der eine mindestens einmalige Erhöhung der Eosinophilenzahl auf ≥ 400/µl eines der Einschlusskriterien war. Untersucht wurden die Dosierungen 0,3 mg/kg Körpergewicht (KG) und 3,0 mg/kg KG im Vergleich zu Placebo. Sowohl die Asthmasymptome als auch die Asthmakontrolle, erhoben mit dem ACQ, verbesserten sich in beiden Interventionsgruppen im Vergleich zu Placebo. Die Verbesserung der Lebensqualität, gemessen mit dem AQLQ, wurde nur bei der höheren Dosierung ersichtlich, war jedoch klinisch nicht relevant (delta of least square mean 0,359 (95% KI 0,047; 0,670). 26493 Die Qualität der Studie ist durch ein unklares Risiko für Selektionsbias, Performance bias, Detection bias und ein hohes Risiko für Attrition bias limitiert.
Die subkutane Anwendung von Benralizumab bei schwerem Asthma wurde in zwei Phase-III-Studien (SIROCCO und CALIMA) untersucht, die sehr ähnliche Studiendesigns, jedoch leicht differierende Beobachtungszeiträume hatten 26489, 26488.
In der Studie CALIMA führte die subkutane Gabe von Benralizumab im 4-Wochen-Intervall (Rate Ratio 0,64 (95% KI 0,49; 0,85) und im 8-Wochen-Intervall (Rate Ratio 0,72 (95% KI 0,54; 0,95)) über einen Zeitraum von 56 Wochen im Vergleich zu Placebo zur Reduktion der jährlichen Exazerbationsrate 26489.
In der Studie SIROCCO führte die subkutane Gabe von Benralizumab im 4-Wochen-Intervall (Rate Ratio 0,55 (95% KI 0,42; 0,71) und im 8-Wochen-Intervall (Rate Ratio 0,49 (95% KI 0,37; 0,64)) über einen Zeitraum von 48 Wochen im Vergleich zu Placebo zur Reduktion der jährlichen Exazerbationsrate 26488.
Die Asthmasymptome verbesserten sich im Vergleich zu Placebo in beiden Studien nur in der Gruppe der im 8-Wochen-Intervall behandelten Patienten 26489, 26488. Unklar bleibt, ob die Ergebnisevaluation in den Studien verblindet erfolgte.
Eine weitere Phase-III-Studien (BISE) untersuchte die Wirksamkeit und Sicherheit von Benralizumab im Vergleich zu Placebo bei Patienten mit mildem bis moderatem Asthma: Hier ergaben sich hinsichtlich des Symptomscores und der asthmabezogenen Lebensqualität keine signifikanten Unterschiede zwischen der Interventions- und der Placebogruppe 27972.
Überdies untersuchte die Studie ZONDA 27973 den corticosteroidsparenden Effekt von Benralizumab über einen Zeitraum von 28 Wochen. Die Chance einer Reduktion von OCS war bei der Gabe von Benralizumab im 4-Wochen-Intervall OR 4,09 (95% KI 2,22; 7,57) und im 8-Wochen-Intervall OR 4,12 (95% KI 0,22; 7,63) höher als bei der Gabe von Placebo 27973.
Ein Wirksamkeitsvergleich zwischen den einzelnen monoklonalen Antikörpern wurde in der systematischen Recherche nicht identifiziert.
In der frühen Nutzenbewertung bewertete das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) die Daten für Mepolizumab, Reslizumab und Benralizumab als nicht geeignet, um Aussagen zu einem Zusatznutzen abzuleiten, da die Vergleichstherapie nicht angemessen war 26704, 26705, 26710, 26749, 28121.
Sicherheit
Zu Sicherheitsaspekten von Mepolizumab, Reslizumab und Benralizumab stehen bisher nur die Zulassungsstudien bzw. teilweise deren Verlängerungen zur Verfügung. In einigen Studien floss der nicht näher bzw. ungenau definierte Endpunkt "Verschlechterung des Asthmas" als unerwünschte Wirkung ein: Hier blieb meist unklar, ob zum Beispiel auch die Effektivitätsendpunkte Exazerbationen oder Symptome mit ausgewertet wurden 26503, 26493, 26494, 26500. Teilweise wurde in den identifizierten Studien ersichtlich, dass es sich dabei auch um Exazerbationen handelt 26490, 26488, 26489, 27973, 27972. Vor diesem Hintergrund lassen sich ähnliche oder erhöhte Raten an unerwünschten und schweren unerwünschten Nebenwirkungen in der Placebogruppe erklären 25185, 26503, 26493, 26494, 26500, 26489, 26488, 27972, 27973.
Hinsichtlich der Sicherheit von Mepolizumab beschreibt die EMA 26703 lokale Reaktionen an der Einstichstelle und systemische allergische und nicht-allergische Reaktionen als identifizierte, wichtige Risiken. Immunogenität, Änderungen der Immunreaktion (Infektionen, maligne Erkrankungen), kardiovaskuläre Veränderungen und eine Symptomverstärkung bei Absetzen von Mepolizumab als mögliche wichtige Risiken. Ausreichend Daten, um die Sicherheit für besondere Patientengruppen, wie schwangere und/oder stillende Frauen, Patienten unter 18 Jahren oder ältere Patienten zu beurteilen, liegen derzeit noch nicht vor. 26703
Die EMA 26709 beschreibt Überempfindlichkeitsreaktionen, wie anaphylaktische und anaphylaktoide Reaktionen als identifizierte, wichtige Risiken bei der Behandlung mit Reslizumab. Parasitäre Infektionen und maligne Erkrankungen sieht sie als mögliche wichtige Risiken. Auch hier fehlen Daten für besondere Patientengruppen, wie zum Beispiel für Patienten unter 18 oder über 75 Jahren, für Schwangere und Stillende sowie für Patienten, die gleichzeitig immunsuppressive Medikamente erhalten. 26709
Die EMA 27976 beurteilt die Sicherheit von Benralizumab anhand der Phase-II- und Phase-III-Studien. Sie identifiziert folgende mögliche wichtige Risiken in der Behandlung mit Benralizumab: schwere Infektionen, parasitäre Infektionen, schwere Überempfindlichkeitsreaktionen, wie anaphylaktoide und anaphylaktische Reaktionen, maligne Erkrankungen und den Verlust bzw. die Reduktion der Langzeiteffektivität durch persistierende neutralisierende Antikörper. Ausreichend Daten für die Beurteilung der Sicherheit für schwangere und/oder stillende Frauen liegen derzeit noch nicht vor. Des Weiteren fehlen Langzeitdaten für die Sicherheit von Benralizumab in der Dosis 30 mg s.c. 27976
Die Aktualisierung der systematischen Recherche für die 4. Auflage der NVL Asthma identifizierte weitere Verlängerungsstudien 29384, 29378, 29377, 29383, die – bis auf eine Ausnahme 29377 – nicht verblindet durchgeführt wurden.
Unerwünschte Wirkungen traten unter Gabe von 3,0 mg/kg i.v. bei reslizumabnaiven Patienten mit schwerem eosinophilen Asthma etwas häufiger auf als bei reslizumaberfahrenen (75% vs. 67%), wobei die häufigsten Ursachen, z. B. die Verschlechterung des Asthmas und Nasopharyngitis, in beiden Gruppen ähnlich verteilt waren 29384. 15 der 1 051 eingeschlossenen Patienten wiesen maligne Erkrankungen auf 29384.
In einer weiteren Studie wurde die subkutane Anwendung von Reslizumab (110 mg) untersucht 29383. Die Ergebnisse waren zum Zeitpunkt der Recherche nur innerhalb eines Studienregisters veröffentlicht. Hier waren die während der Behandlung aufgetretenen unerwünschten Wirkungen in der reslizumabnaiven Gruppe etwas seltener als in der reslizumaberfahrenen (52,6% vs. 58,2%) 29383.
Mepolizumab in der Anwendung von 100 mg s.c. alle 4 Wochen führte bei 94% der Patienten zu unerwünschten und bei 23% zu schweren unerwünschten Wirkungen 29378. Häufig berichtet wurden Infektionen des Respirationstraktes (67%), Kopfschmerzen (29%) und eine Verschlechterung des Asthmas (27%), die bei 10% der eingeschlossenen Patienten als schweres unerwünschtes Ereignis klassifiziert wurde 29378.
Die Anzahl der Patienten, die unter Benralizumab 30 mg s.c., alle 4 oder alle 8 Wochen, unerwünschte oder schwere unerwünschte Wirkungen erlitt, ähnelte sich zwischen benralizumabnaiven und benralizumaberfahrenen Patienten 29377.
Basierend auf diesen Daten empfehlen die Autoren einen Therapieversuch mit den Wirkstoffen Mepolizumab, Reslizumab und Benralizumab für eine eng definierte Patientengruppe (siehe Empfehlung 4-35). Studien, die die Wirksamkeit und Sicherheit der monoklonalen Antikörper untereinander vergleichen, wurden nicht identifiziert. Die Patientengruppe ergibt sich durch die Einschlusskriterien und Ergebnisse der zitierten Zulassungsstudien. Die Behandlung mit Anti-IL-5-(R)-Antikörpern ermöglicht aus Sicht der Autoren, die Therapie mit OCS zu reduzieren und ggf. zu beenden. Die Autoren der Leitlinie sprechen eine abgeschwächte Empfehlung aus, da zur Beurteilung der Langzeitverträglichkeit der Anti-IL-5-(R)-Antikörper zu wenige Daten vorliegen.
Eine Indikation zur Verordnung der gegen IgE und IL-5-(R) gerichteten monoklonalen Antikörper für aktive Raucher und Patienten mit COPD besteht aus Sicht der Leitliniengruppe nicht. In die klinischen Prüfungen wurden bisher hauptsächlich Nicht- oder ehemalige Raucher mit einer Zigarettenanamnese von ≤ 10 Packungsjahren eingeschlossen 25185, 26503, 26490, 26500, 26494, 26493, 25390, 27973, 26488, 26489. Daraus schließen die Autoren, dass keine Hinweise auf eine Wirksamkeit bei aktiven Rauchern oder Patienten mit einer klinisch führenden COPD vorliegen. Insbesondere bei ehemaligen Rauchern mit einem deutlich über diese Grenze hinausgehenden Zigarettenkonsum erachten es die Autoren daher als wichtig, dass die Diagnose Asthma klinisch führend ist und die Abgrenzung zu einer COPD durch einen im Management schwergradiger obstruktiver Atemwegserkrankungen erfahrenen Pneumologen erfolgt (siehe Empfehlungen 4-34 und 4-35 und Kapitel 2.10 Asthma-COPD-Overlap).
4.8.6.4 Dupilumab
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Ein Therapieversuch mit Dupilumab für mindestens vier Monate sollte bei Erwachsenen in Stufe 5 erwogen werden, wenn folgende Kriterien vorliegen:
|
|
In der systematischen Recherche wurden zwei Phase-III-Studien mit randomisiert kontrolliertem Design identifiziert, die die Wirksamkeit und Sicherheit von Dupilumab im Vergleich zu Placebo jeweils als Zusatz zur bisherigen Therapie bei Patienten ab 12 Jahren mit unkontrolliertem mittelschwerem bis schwerem Asthma (n = 1 902) 29306 bzw. mit schwerem, OCS-abhängigem Asthma (n = 210) 29305 untersuchten.
Die adjustierte jährliche Rate schwerer Exazerbationen war bei der zweiwöchentlichen Anwendung von 200 mg Dupilumab (n = 948) RR 0,523 (95% KI 0,413; 0,662) und 300 mg Dupilumab (n = 954) RR 0,540 (95% KI 0,430; 0,680) jeweils im Vergleich zu Placebo geringer 29306. Aus den prädefinierten Subgruppenanalysen ergaben sich Hinweise, dass die Wirksamkeit ab einer Eosinophilenzahl von ≥ 150 Zellen/µl Blut bzw. ab einem FeNO-Wert von ≥ 25 ppm am größten war 29306. Die Ergebnisse der Subgruppenanalysen sind im Anhang 15.1 des Leitlinienreports dokumentiert 30114. Das Verzerrungsrisiko in der Kategorie Reporting bias wird als unklar eingeschätzt.
Die prozentuale Reduktion der Dosis von OCS war bei der Anwendung von 300 mg Dupilumab nach 24 Wochen größer als unter Placebo (-70,1 ± 4.9% vs. -41,9 ± 4.6%; LSMD -28,2 (95% KI -40,7; -15,8) n = 210) 29305. Auch in dieser Studie wird das Verzerrungsrisiko in der Kategorie Reporting bias als unklar eingeschätzt.
Sicherheit
Zu Sicherheitsaspekten von Dupilumab stehen bisher die Zulassungsstudien zur Verfügung: In den identifizierten Phase-III-Studien traten im Gruppenvergleich ähnlich viele unerwünschte und schwere unerwünschte Effekte jeglicher Art auf 29305, 29306. Die EMA weist darauf hin, dass die häufigste schwere unerwünschte Wirkung Asthma war. Exazerbationen traten in den Gruppen, die mit 200 mg Dupilumab oder Placebo behandelt wurden, häufiger auf als in der mit 300 mg Dupilumab behandelten Gruppe 29831. Reaktionen an der Injektionsstelle waren bei Anwendung von Dupilumab häufiger als unter Placebo 29305, 29306.
Die EMA 29831, 30225 beurteilt die Sicherheit von Dupilumab anhand der Phase-II- und Phase-III-Studien. Sie beschreibt systemische Überempfindlichkeitsreaktionen, inklusive Immunogenität, als wichtige identifizierte Risiken in der Behandlung mit Dupilumab. Ausreichend Daten für die Beurteilung der Sicherheit für schwangere und/oder stillende Frauen liegen derzeit noch nicht vor. Des Weiteren fehlen Langzeitdaten für die Sicherheit von Dupilumab 29831, 30225.
Wegen der postivien Effekte auf die Rate schwerer Exazerbationen und der Möglichkeit der Reduktion von OCS sieht die Leitliniengruppe eine Option für einen Therapieversuch mit Dupilumab in Stufe 5 für die in Empfehlung 4-36 eng umschriebene Patientengruppe, die nach Ausschöpfen der inhalativen Therapie keine Asthmakontrolle erreichte. Gleichzeitig stellt sie fest, dass in den Studien keine Vergleiche zu den anderen – schon länger zugelassenen – monoklonalen Antikörpern erfolgten, wodurch eine vergleichende Beurteilung erschwert ist. Die Leitlinienautoren weisen darauf hin, dass die Ergebnisse der FeNO-Messung und der Bestimmung von Eosinophilen im Blut durch die Gabe von systemischen Corticosteroiden beeinflusst sein kann.
4.8.6.5 Behandlung mit monoklonalen Antikörpern
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Die Indikationsstellung und Initiierung einer Behandlung mit monoklonalen Antikörpern soll bei Erwachsenen durch in der Versorgung von schwerem Asthma erfahrene pneumologische Fachärzte erfolgen. |
|
|
Die Wirksamkeit der Therapie mit monoklonalen Antikörpern soll nach vier und zwölf Monaten, dann in jährlichem Abstand evaluiert werden. |
|
|
Die vor Beginn der Behandlung mit monoklonalen Antikörpern bestehende Langzeittherapie soll zunächst beibehalten und erst nach eindeutigem klinischen Ansprechen, kenntlich an einer Verbesserung der Asthmakontrolle, unter engmaschiger Kontrolle reduziert werden. |
|
In Anbetracht der Schwere der Erkrankung, die eine Behandlung mit monoklonalen Anktikörpern notwendig macht, erachtet es die Leitliniengruppe als wichtig, dass Patienten einem pneumologischen Facharzt vorgestellt werden. Ziel der Beurteilung durch einen pneumologischen Facharzt sind die Indikationsstellung, die Feststellung der Zeitpunkte einer Therapieintensivierung und -reduktion sowie das Erkennen von Risikosignalen, die sich während der Behandlung ergeben können. Da die Evidenzlage für all diese Parameter zum aktuellen Zeitpunkt noch nicht aussagekräftig genug ist (siehe Empfehlungen 4-34, 4-35 und 4-36), benötigt die Behandlung dieser Patienten eine besondere klinische Expertise.
Die Grundlage für die Zeiträume der Re-Evaluierung der Therapie bilden die in den Zulassungsstudien der monoklonalen Antikörper verwendeten Zeitpunkte der Endpunktmessungen 26500, 26503, 25185, 25390, 26494, 26493, 26490. Aus Sicht der Leitliniengruppe lässt sich ein Therapieeffekt frühestens nach einer viermonatigen Anwendungsdauer evaluieren. Innerhalb dieser Zeitspanne ist es aus ihrer Sicht möglich, Non-Responder zu identifizieren.
In den identifizierten Studien wurden die Zeitpunkte des Beginns der Steroidreduktion unterschiedlich bestimmt. Der systematische Review von Normansell et al. 25390 schloss fünf Primärstudien ein, die die Wirksamkeit und Sicherheit von Omalizumab auch in der Steroidreduktionsphase untersuchten. Die zuvor bestehende steroidstabile Phase betrug zwischen 12 und 28 Wochen 25390. Während der Therapie mit Mepolizumab sowie Benralizumab wurde die Reduktion von OCS bereits nach einer vierwöchigen steroidstabilen Phase begonnen 26503, 27973. Da die Zeiträume uneinheitlich sind und für Reslizumab derzeit noch keine Daten zur Steroidreduktion identifiziert wurden, empfiehlt die Leitliniengruppe den Zeitpunkt der Reduktion der zuvor bestehenden Langzeittherapie an der Asthmakontrolle zu orientieren (siehe Abbildung 2 und Abbildung 3) und den Patienten dabei engmaschig zu betreuen.
Die Therapiedauer mit monoklonalen Antikörpern orientiert sich ebenfalls an der Asthmakontrolle. Zeigt sich bei den Kontrollintervallen keine Besserung der Asthmakontrolle, wird empfohlen, die monoklonalen Antikörper abzusetzen.
4.8.6.6 Orale Corticosteroide
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Die Langzeittherapie mit systemischen Corticosteroiden soll bei Erwachsenen in Stufe 5 wegen der Gefahr schwerer Nebenwirkungen nicht empfohlen werden, es sei denn, die Asthmakontrolle ist trotz des kombinierten Einsatzes der verschiedenen Therapieoptionen der vorherigen Stufe sowie zusätzlich monoklonaler Antikörper (sofern indiziert und wirksam) unzureichend. |
|
Systemische Corticosteroide werden seit langem in der Praxis eingesetzt. Neue Erkenntnisse zu Wirksamkeit und Sicherheit wurden in der systematischen Recherche nicht identifiziert.
Sie werden in der geringstmöglichen Dosis empfohlen, um das Risiko für unerwünschte Wirkungen zu minimieren. Bei erwachsenen Patienten sind insbesondere das Risiko für eine Blutdrucksteigerung und die Entwicklung eines Diabetes mellitus sowie einer Osteoporose zu beachten. Auch wenn zum aktuellen Zeitpunkt nur begrenzte Langzeiterhebungen für die Sicherheit der verschiedenen monoklonalen Antikörper vorliegen (siehe Empfehlungen 4-34, 4-35 bis 4-39), werden die unerwünschten Langzeitwirkungen von systemischen Corticosteroiden als so erheblich eingeschätzt, dass die Leitliniengruppe OCS als nachrangige Therapieoption für die Langzeittherapie in Stufe 5 einordnen.
4.8.7 Stufe 5 | Kinder und Jugendliche
Die Autoren der NVL Asthma entschließen sich, eine zusätzliche Stufe in das Stufenschema für Kinder und Jugendliche einzufügen, die zwischen dem Einsatz von mittel- und hochdosierten ICS differenziert.
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bevor bei Kindern und Jugendlichen die Eskalation der Therapie zur Stufe 5 erfolgt, soll die Wirksamkeit der verschiedenen möglichen Therapieoptionen der Stufe 4 evaluiert werden. |
|
|
Kinder und Jugendliche, deren Asthma eine Behandlung in Stufe 5 erfordert, sollen zu einem pädiatrischen Pneumologen überwiesen werden. |
|
|
Kinder und Jugendliche sollten vor dem Übergang in Stufe 5 zur erweiterten Diagnostik in einem kinderpneumologischen Zentrum vorgestellt werden. |
|
|
Bei Kindern und Jugendlichen sollte vor der Behandlung in Stufe 5 die Indikation zu einer stationären Rehabilitation geprüft werden. |
|
|
Bei Kindern und Jugendlichen soll in Stufe 5 eine Kombinationstherapie aus einem hochdosierten ICS mit einem LABA oder/und einem LTRA empfohlen werden. |
|
In der systematischen Recherche wurden zwei systematische Übersichtsarbeiten identifiziert, die den Übergang von Stufe 4 zu 5 untersuchen 25902, 25686.
Indirekt kann die Subgruppenanalyse von Ducharme et al. 25902 herangezogen werden. Ohne für die Altersgruppe zu differenzieren, wurde die Kombination aus einem mitteldosierten ICS plus LABA mit einer höher dosierten ICS-Monotherapie verglichen. Es ergab sich kein signifikanter Unterschied für das Risiko für Exazerbationen, die eine Behandlung mit OCS erforderten (RR 1,21 (95% KI 0,69; 2,12), n = 445, 3 RCTs). 25902
Die Kombinationstherapie aus ICS plus LTRA verglichen mit einer ICS-Monotherapie in höherer Dosis, zeigte keinen signifikanten Unterschied bezüglich der Exazerbationen, die OCS erfordern (RR 0,82 (95% KI 0,54; 1,25) 1 RCT, n = 182, Datenqualität niedrig) 25686.
Die Therapieoptionen innerhalb der Stufe 5 wurden in zwei systematischen Übersichtsarbeiten verglichen, die indirekt herangezogen werden können:
Für den geplanten Vergleich zwischen der Kombinationstherapie aus ICS hochdosiert plus LABA mit einer hochdosierten ICS-Monotherapie bei Kindern und Jugendlichen konnten Chauhan et al. keine Primärstudien identifizieren 25074.
Die Höhe der ICS-Dosis wurde im nächsten Vergleich dieses systematischen Reviews 25074 nicht differenziert: Zwischen der Gruppe, die ICS plus LABA und der Gruppe, die nur ICS in der gleichen Dosis erhielten, unterschied sich weder die Anzahl der Patienten, die eine Exazerbation mit der Notwendigkeit der Gabe von systemischen Corticosteroiden hatte (RR 0,95 (95% KI 0,70; 1,28) 12 RCTs n = 1 669; I² = 0) noch die Anzahl der Patienten mit Exazerbationen, die eine Hospitalisierung erforderte, signifikant (RR 1,74 (95% KI 0,90; 3,36) 6 RCTs, n = 1 292; I² = 0%). 25074 Die Datenqualität wird jeweils aufgrund der Indirektheit auf niedrig abgewertet.
Zudem steht eine Subgruppenanalyse 25901 zur Verfügung, die aufgrund der fehlenden Differenzierung des Alters indirekt genutzt werden kann. Der Vergleich der hochdosierten ICS-Monotherapie zu ICS hochdosiert plus LABA ergab keinen signifikanten Unterschied für den Endpunkt Exazerbationen, die eine Behandlung mit OCS erfordern (POR 0,94 (95% KI 0,58; 1,54); n = 1 366, 7 RCTs) 25901.
Zwei in der systematischen Recherche identifizierte Phase-III-Studien untersuchten die Wirksamkeit und Sicherheit von Tiotropium bei Patienten, die trotz einer Kombinationstherapie aus hochdosierten ICS plus mindestens einem weiteren Langzeittherapeutikum oder aus einem mitteldosierten ICS plus mindestens zwei weiteren Langzeittherapeutika ein symptomatisches Asthma aufwiesen 26589, 26590.
Ein RCT 26590 untersuchte die Anwendung von Tiotropium bei 392 Jugendlichem im Verglichen zu Placebo bei einer Studiendauer von 12 Wochen. Die Asthmakontrolle unterschied sich nicht signifikant im Gruppenvergleich. Schwere Asthmaexazerbationen waren in der Gruppe, der mit 5 µg behandelten Patienten am häufigsten (2,5 μg: 0,79%; Placebo: 0,74%; 5 μg: 1,54%). Mindestens eine Episode einer Asthmaverschlechterung trat in der mit Placebo behandelten Gruppe am häufigsten auf (5 μg: 11,5%; 2,5 μg: 14,2%; Placebo: 18,5%). Asthmaexazerbationen und die Verschlechterung des Asthmas wurden als sekundärer Endpunkt und als unerwünschte Wirkung erfasst. 26590 Das Risiko für Reporting Bias wird als hoch eingeschätzt.
Eine weitere Studie 26589 untersuchte 635 Kinder im Alter zwischen sechs und elf Jahren, die zusätzlich über einen Zeitraum von 12 Wochen mit Tiotropium in der Dosis von 2,5 µg oder 5 µg oder mit Placebo behandelt wurden. Für die Endpunkte Veränderungen im ACQ-1A-Score, symptomfreie Tage und Notfallmedikation ergab sich jeweils kein signifikanter Unterschied zwischen der Placebogruppe und der jeweiligen Intervention in den unterschiedlichen Dosierungen. Die Häufigkeit von unerwünschten Wirkungen war in den Interventionsgruppen geringer als in der Placebogruppe (5 µg: 43,1%; 2,5 µg: 43,4%, Placebo: 49,3%). Schwere unerwünschte Wirkungen traten in der Dosierung von 5 µg mit 3,1% am häufigsten auf und lagen in der Dosierung von 2,5 µg und unter Placebo jeweils bei 1,5%. 26589 Limitierend ist das unklare Verzerrungspotentials bezüglich der Verblindung der Ergebnisevaluation.
Basierend auf diesen Ergebnissen und der eigenen klinischen Erfahrung erscheint es der Leitliniengruppe wichtig, darauf hinzuweisen, dass zunächst die individuell anwendbaren Therapiealternativen der Stufe 4 evaluiert werden, bevor eine Eskalation zur Stufe 5 erfolgt. Sicherheitsbedenken bezüglich einer höheren ICS-Dosierung stehen dabei im Vordergrund (siehe Empfehlung 4-25). Kinderpneumologische Zentren ermöglichen eine erweiterte Diagnostik für den Fall, dass die Diagnose verifiziert werden müsste. In einer stationären Rehabilitationsmaßnahme kann die Therapieadhärenz der Kinder im Sinne einer kontrollierten Therapie beobachtet und das Verhalten geschult werden. In diesen Maßnahmen sehen die Leitlinienautoren die Chance, eine unnötige Therapieeskalation zu vermeiden.
4.8.8 Stufe 6 | Kinder und Jugendliche
4.8.8.1 Vorbemerkung
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bevor bei Kindern und Jugendlichen die Eskalation der Therapie zur Stufe 6 erfolgt, soll die Wirksamkeit der verschiedenen möglichen Therapieoptionen der Stufe 5 evaluiert werden. |
|
|
Kinder und Jugendliche sollen vor dem Übergang in Stufe 6 zur Durchführung der Differentialdiagnostik und Untersuchung auf Komorbiditäten in einem kinderpneumologischen Zentrum mit der Möglichkeit zur invasiven Diagnostik vorgestellt werden. |
|
|
Bei Kindern und Jugendlichen soll vor der Behandlung in Stufe 6 die Indikation zu einer stationären Rehabilitation geprüft werden. |
|
Die Empfehlungen beruhen auf einem Expertenkonsens. Vor dem Übergang zu der Behandlung in Stufe 6 empfiehlt die Leitliniengruppe die bereits in Stufe 5 genannten Maßnahmen, jedoch mit einem stärkeren Empfehlungsgrad. Vor der Behandlung mit monoklonalen Antikörpern oder OCS kommt dem Ausschluss von Differentialdiagnosen und relevanten Komorbiditäten eine höhere Bedeutung zu. Gleiches gilt für die Überprüfung der Therapieadhärenz im Rahmen einer stationären Rehabilitation.
4.8.8.2 Omalizumab
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Ein Therapieversuch mit Omalizumab für mindestens vier Monate soll bei Kindern ab sechs Jahren sowie Jugendlichen ab Stufe 6 empfohlen werden, wenn folgende Kriterien vorliegen:
|
|
Die Evidenzgrundlage für die Empfehlung bilden die in der systematischen Recherche identifizierten systematischen Übersichtsarbeiten und HTA-Berichte 25390, 25142, 25681, 26761, 26755, 26754. Deren Inhalte sind im Hintergrundtext der Empfehlung 4-34 im Kapitel 4.8.6 Stufe 5 | Erwachsene dargestellt. Dort sind auch die Sicherheitsaspekte aufgeführt.
Zusätzlich zu der systematischen Übersichtsarbeit von Normansell et al., die Kinder und Erwachsene gemeinsam betrachtet 25390, werden die Ergebnisse der systematischen Übersichtsarbeit von Rodrigo et al. zitiert, die Kinder und Jugendliche mit moderatem bis schwerem persistierendem allergischem Asthma untersucht 25195.
Im Vergleich zu Placebo war unter Omalizumab sowohl die Anzahl der Patienten mit mindestens einer Exazerbation (26,7% vs. 40,6%, RR 0,69 (95% KI 0,59; 0,80); I² = 0%, 3 RCTs, n = 1 329) als auch die Anzahl der Patienten mit Exazerbationen, die eine Hospitalisierung erforderlich machten (2,0% vs. 4,7%; RR 0,35 (95% KI 0,2; 0,64); I² = 29%, 3 RCTs, n = 1 381), geringer 25195. Während schwere unerwünschte Wirkungen bei Patienten seltener waren, die mit Omalizumab behandelt wurden (5,2% vs. 5,6%), traten jegliche unerwünschte Wirkungen in der Placebogruppe etwas seltener auf (76,3% vs. 74,2%). Beide Ergebnisse waren statistisch nicht signifikant. 25195 Als limitierend wird bei diesen Ergebnissen angesehen, dass aus dem systematischen Review nicht hervorgeht, ob Exazerbationen als Effektivitätsendpunkt zusätzlich mit in die unerwünschten Wirkungen (als Sicherheitsendpunkt) einfließen und damit eine doppelte Darstellung erfolgt.
In Zusammenschau der identifizierten Evidenz und der wenigen Therapiealternativen empfiehlt die Leitliniengruppe einen Therapieversuch mit Omalizumab bei Kindern ab einem Alter von sechs Jahren, wenn die in Empfehlung 4-49 genannten eng umschriebenen Kriterien erfüllt sind. Entscheidend ist, vor Initiierung der Therapie alle vermeidbaren Allergene zu eliminieren (siehe Kapitel 6.8 Verminderung der Allergenexposition) und – wenn bei Jugendlichen notwendig – die Möglichkeiten der Tabakentwöhnung vor Therapiebeginn auszuschöpfen (siehe Kapitel 6.5 Tabakentwöhnung).
4.8.8.3 Mepolizumab
Für die 3. Auflage der NVL Asthma wurde eine systematische Recherche zur Wirksamkeit und Sicherheit von Anti-IL5-(R)-Antikörpern durchgeführt. Diese wurde aktualisiert, um zu prüfen, ob in der Zwischenzeit Studien für die Anwendung bei Kindern und Jugendlichen vorliegen. Identifiziert wurden jedoch nur die Verlängerungsstudien der im Kapitel 4.8.6.3 Mepolizumab, Reslizumab und Benralizumab beschriebenen RCTs. Die Verlängerungsstudien wurden teilweise verblindet 29377 und teilweise unverblindet 29384, 29378, 29383 durchgeführt.
Im aktualisierten Cochrane-Review 29397 und in den identifizierten Primärstudien zur Wirksamkeit und Sicherheit von Anti-IL5-(R)-Antikörpern 26503, 26490, 29378 konnte anhand der Baseline-Charakteristika nicht ermittelt werden, wieviele Patienten unter 18 Jahren eingeschlossen wurden. Darüber hinaus wurden keine Subgruppenanalysen für die primären Endpunkte für diese Altersgruppe identifiziert 29378, 29397, 26503, 26490.
Die EMA begründet eine partielle Extrapolation der Daten im Assessment Report 29835 damit, dass schweres eosiniphiles Asthma bei Kindern und Jugendlichen selten auftritt und Studien schwer umsetzbar sind. Sie berechnet den Endpunkt klinisch bedeutsame Exazerbationen auf Basis der Daten der zur Verfügung stehenden Primärstudien altersgruppenspezifisch. Bei einer geringen Anzahl von jugendlichen Patienten ergibt sich laut EMA ein weites Konfidenzintervall, das den Nullwert schneidet, der Effektschätzer weist jedoch in die gleiche Richtung wie in der Gesamtbetrachung der Altersgruppen. 29835
Für Kinder zwischen 6 bis 11 Jahren lag der EMA eine unverblindete, nicht kontrollierte Studie mit geringer Teilnehmerzahl vor (n = 26), in der sich Hinweise für eine Besserung der Asthmakontrolle nach einem Zeitraum von 12 Wochen ergaben 29835.
Das Sicherheitsprofil wird von der EMA 29835 für Kinder und Jugendliche ähnlich eingeschätzt wie das der Erwachsenen, wobei Kopfschmerzen und Reaktionen an der Injektionsstelle die häufigsten unerwünschten Wirkungen darstellten. Der prozentuale Anteil von Kindern mit nicht-tödlichen schweren unerwünschten Wirkungen war höher der als bei Jugendlichen und Erwachsenen. Die EMA weist jedoch auf die Unsicherheiten dieser Einschätzungen aufgrund der geringen Fallzahlen bzw. der kurzen Behandlungsdauer (12 Wochen) bei Kindern hin. 29835
Das IQWiG schätzt die verfügbaren Daten als nicht geeignet bzw. als nicht ausreichend für einen Evidenztransfer ein 29914.
Die Leitliniengruppe sieht seit der Zulassung von Mepolizumab bei Kindern ab 6 Jahren die Möglichkeit für einen Therapieversuch zur Behandlung des schweren Asthmas in Stufe 6, jedoch – sofern bei Vorliegen entsprechender Indikationskriterien beide monoklonalen Antikörper eingesetzt werden könnten – nachrangig zur Therapie mit Omalizumab (siehe Abbildung 5).
4.8.8.4 Dupilumab
In der systematischen Recherche wurde zwei Phase-III-Studien identifiziert, die Patienten ab einem Alter von 12 Jahren einschlossen 29306, 29305. In der Studie Asthma Liberty Quest waren 5,6% der eingeschlossenen Patienten zwischen 12 und 18 Jahre alt 29306. Subgruppenanalysen für die Effektivität und Sicherheit von Dupilumab bei der Altergruppe der 12 bis 18-Jährigen wurden in den Studien nicht identifiziert 29306, 29305.
Die EMA schildert in ihrem Assessment Report 29831, dass das mittlere Alter der 107 eingeschlossenen Jugendlichen in der Studie Asthma Liberty Quest 14,2 Jahre bei einer Spanne von 12 bis17 Jahren betrug. Darüber hinaus berichtet sie, dass die adjustierte jährliche Rate schwerer Exazerbationen bei Anwendung von 200 mg Dupilumab geringer war als unter Placebo (0,191 vs. 0,356). Im Vergleich der Gruppen 300 mg Dupilumab vs. Placebo habe sich kein Unterschied ergeben. Sie zeigt auf, dass in der Studie Asthma Liberty Venture lediglich drei Patienten unter 18 Jahren eingeschlossen wurden. 29831
Die EMA berichtet zudem die unerwünschten (Dupilumab 200 mg: 70,6%; Dupilumab 300 mg: 76,5%; Placebo: 76,2% bzw. 88,9%) und schweren unerwünschten Effekte jeglicher Art (Dupilumab 200 mg: 8,8%; Dupilumab 300 mg: 2,9%; Placebo: 0 bzw. 11,1%) bei Jugendlichen in der Studie Asthma Liberty Quest 29831. Der eine Jugendliche, der in der Studie Asthma Liberty Venture zur Verumgruppe randomisiert wurde, habe keine unerwünschten Wirkungen gezeigt 29831.
Die Leitliniengruppe schätzt die oben beschriebenen Daten als einen Hinweis für positive Effekte auf die Rate schwerer Exazerbationen ein. Sie sieht eine Option für einen Therapieversuch mit Dupilumab in Stufe 6 für Patienten ab 12 Jahren, jedoch – sofern bei Vorliegen entsprechender Indikationskriterien beide monoklonalen Antikörper eingesetzt werden könnten – nachrangig zur Therapie mit Omalizumab (siehe Abbildung 5).
Gleichzeitig stellt sie fest, dass in den Studien keine Vergleiche zu den anderen – schon länger zugelassenen – monoklonalen Antikörpern erfolgten, wodurch eine vergleichende Beurteilung erschwert ist. Die Leitliniengruppe weist darauf hin, dass die Ergebnisse der FeNO-Messung und der Bestimmung von Eosinophilen im Blut durch die Gabe von systemischen Corticosteroiden beeinflusst sein kann.
4.8.8.5 Behandlung mit monoklonalen Antikörpern
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Die Indikationsstellung und Initiierung einer Behandlung mit monoklonalen Antikörpern soll bei Kindern und Jugendlichen durch in der Versorgung von schwerem Asthma erfahrene pädiatrische Pneumologen erfolgen. |
|
Die Details der Anwendung monoklonaler Antikörper sind in den Empfehlungen 4-38 und 4-39 und dem dazugehörigen Hintergrundtext für Erwachsene beschrieben und gelten analog auch für Kinder und Jugendliche (siehe Kapitel 4.8.6 Stufe 5 | Erwachsene).
In Anbetracht der Schwere der Erkrankung, die eine Behandlung mit monoklonalen Anktikörpern notwendig macht, erachtet es die Leitliniengruppe als wichtig, dass Patienten einem pädiatrischen Pneumologen vorgestellt werden. Ziel der Beurteilung durch den pädiatrischen Pneumologen sind die Indikationsstellung, die Feststellung der Zeitpunkte einer Therapieintensivierung und -reduktion sowie das Erkennen von Risikosignalen, die sich während der Behandlung ergeben können. Da die Evidenzlage für all diese Parameter zum aktuellen Zeitpunkt noch nicht aussagekräftig genug ist (siehe Hintergrundtext zu den Empfehlungen 4-34 und 4-49), benötigt die Behandlung dieser Patienten eine besondere klinische Expertise.
4.8.8.6 Systemische Corticosteroide
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Die Langzeittherapie mit systemischen Corticosteroiden soll bei Kindern und Jugendlichen in Stufe 6 wegen der Gefahr schwerer Nebenwirkungen nicht empfohlen werden, es sei denn, die Asthmakontrolle ist trotz des kombinierten Einsatzes der verschiedenen Therapieoptionen der vorherigen Stufe sowie zusätzlich monoklonaler Antikörper (sofern indiziert und wirksam) unzureichend. |
|
Die Langzeittherapie mit systemischen Corticosteroiden bildet bei Kindern und Jugendlichen in Stufe 6 wegen der Langzeitfolgen eine nachrangige Therapiealternative in begründeten Fällen. In der Empfehlung 4-25 empfehlen die Leitlinienautoren gezielte Maßnahmen zur Vermeidung bzw. Früherkennung von unerwünschten Wirkungen für Kinder und Jugendliche durch Corticosteroide.
4.9 Spezifische (Allergen-) Immuntherapie bei allergischem Asthma
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei Patienten mit allergischem Asthma soll die Indikation zu einer spezifischen Immuntherapie (SIT) geprüft werden, wenn die allergische Komponente der asthmatischen Beschwerden gut dokumentiert ist (nachgewiesene spezifische Sensibilisierung und eindeutige klinische Symptomatik nach Allergenexposition). |
|
|
Die Indikationsstellung sowie die Auswahl der Antigene und der Applikationsform sollten von einem allergologisch qualifizierten Arzt (möglichst mit der Zusatzbezeichnung Allergologie) vorgenommen werden. |
|
|
Sondervotum der DEGAM zur Empfehlung 4-53 Die Indikationsstellung sowie die Auswahl der Antigene und der Applikationsform sollen von einem allergologisch erfahrenen Arzt vorgenommen werden. |
|
In der systematischen Literaturrecherche wurden mehrere systematische Übersichtsarbeiten identifiziert, die die Wirksamkeit und Sicherheit einer subkutanen und sublingualen Immuntherapie untersuchten 25152, 25771, 25174, 25145, 25732.
Es gibt Hinweise, dass die verschiedenen Formen der Immuntherapie bei Asthma mit oder ohne allergischer Rhinitis die asthmaspezifischen Endpunkte verbessern, jedoch auch ein Risiko für unerwünschte Wirkungen mit sich bringen 25152, 25771.
Der Cochrane-Review von Normansell et al. erachtet die Evidenzbasis als nicht ausreichend, um valide Aussagen zur Wirksamkeit und Sicherheit einer sublingualen Immuntherapie zu tätigen 25174.
Die Leitliniengruppe formuliert in der Empfehlung 4-52 daher nur Kriterien, bei denen die Indikation für eine SIT im Rahmen der Asthmatherapie geprüft werden soll. Für die Durchführung der spezifischen Immuntherapie wird auf die S2k-Leitlinie zur (allergen-)spezifischen Immuntherapie bei IgE-vermittelten allergischen Erkrankungen der DGAKI verwiesen (www.awmf.org/leitlinien/detail/ll/061-004.html) 26836.
Die Indikationsstellung sowie die Auswahl von Antigenen und der Applikationsform erfordern die Expertise eines allergologisch qualifizierten Arztes. Die Nutzen-Schaden-Abwägung und die Verhinderung schwerer unerwünschter Effekte sind dabei vordergründig. Bei der Auswahl der Antigene ist die nachgewiesene Wirksamkeit zu beachten.
Vor dem Hintergrund, dass flächendeckend ggf. nicht genügend Allergologen tätig sind und die Ausbildung teilweise unattraktiv ist, wird der Klammerausdruck durch das Wort "möglichst" eingeschränkt. Zudem trägt der ohnehin abgeschwächte Empfehlungsgrad dem Umstand Rechnung. Wenn es in der Versorgungssituation nicht anders machbar ist, dann können auch andere Ärzte die Indikationsstellung übernehmen. Die Empfehlung soll nicht dazu führen, dass Patienten unterversorgt sind.
|
Begründung der DEGAM für das Sondervotum zur Empfehlung 4-53 Im Sinne einer Breitenversorgung sind zahlreiche Patienten mit allergischen Erkrankungen auf die Behandlung durch ihre Hausärzte angewiesen. Das Erkennen sowie die Behandlung allergischer Erkrankungen, sowie eventuell daraus entstehender Notfälle inklusive eines anaphylaktischen Schocks, sind ein wichtiger Bestandteil der Weiterbildung im Fach Allgemeinmedizin. Seit Jahren führen viele Hausärzte die spezifische Immuntherapie (SIT) auch ohne den Erwerb der Zusatzweiterbildung Allergologie durch. Bislang sind zahlreiche Fachgruppen zur Abrechnung der Leistungen zur Hyposensibilisierung berechtigt, unter anderem Fachärzte für Allgemeinmedizin, Internisten mit und ohne Schwerpunkt und Kinderärzte. Eine Zusatzbezeichnung Allergologie ist und war bisher hierfür nicht erforderlich. Diese Berechtigung führt dazu, dass die genannten Fachgruppen seit Jahren an der Diagnostik und Behandlung von Patienten mit allergischen Erkrankungen – und damit auch an der Indikationsstellung und Durchführung einer Immuntherapie – beteiligt sind. Die DEGAM hält die Indikationsstellung und Durchführung einer SIT durch allergologisch erfahrene Hausärzte für weiterhin vertretbar. Eine Einschränkung auf Ärztinnen und Ärzte mit der Zusatzbezeichnung Allergologie würde die breite Versorgung der Bevölkerung gefährden, weil nur verhältnismäßig wenige Ärzte/innen über diese Zusatzbezeichnung verfügen, da deren Erwerb eine zusätzliche Weiterbildungszeit von 18 Monaten erfordert, wobei nur verhältnismäßig wenige Einrichtungen über eine entsprechende Weiterbildungsermächtigung verfügen. |
4.10 Nicht-empfohlene Medikamente
Antitussiva und Mukoregulatoren sind aus Sicht der Leitliniengruppe in der Asthmatherapie nicht indiziert. Ein evidenzbasierter Nachweis der Wirksamkeit dieser Substanzen beim Asthma wurde nicht identifiziert. Darüber hinaus besteht ein Potential für unerwünschte Arzneimittelwirkungen. Die asthmatypische Hustensymptomatik lässt sich meist gut durch die empfohlene antientzündliche Therapie beeinflussen.
4.11 Inhalationssysteme
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Die Auswahl des Inhalationssystems soll sich nach den kognitiven und motorischen Fähigkeiten (u. a. dem inspiratorischen Fluss) sowie den Präferenzen des Patienten richten. |
|
|
Die Wirkstoffdeposition im Bronchialsystem wird durch die korrekte Anwendung der Inhalationssysteme entscheidend beeinflusst. Dabei ist zu berücksichtigen, dass für die verschiedenen Inhalationssysteme und Altersgruppen unterschiedliche Inhalationstechniken und Atemmanöver als optimal anzusehen sind. |
Statement |
Die Empfehlungen basieren primär auf guter klinischer Praxis und Expertenwissen. Inhalationssysteme werden in Dosieraerosole, Pulverinhalatoren und elektrische Vernebler zur Feuchtinhalation unterschieden. Bei der Vielzahl der vorhandenen Inhalationssysteme ist es wichtig, die individuellen Fähigkeiten und Präferenzen der Patienten zu berücksichtigen. Schwierigkeiten in der Handhabung der Inhalationssysteme stellen keinen Grund für die orale Applikation inhalativ verfügbarer Medikamente dar (siehe Empfehlung 4-1). Da die Inhalationssysteme sich in einer ständigen Entwicklung befinden, ist es unumgänglich, die Anwendungshinweise aus der jeweiligen Fachinformation heranzuziehen und abzugleichen. Allgemeine Prinzipien der Anwendung von Inhalationssystemen sind:
1. Vor der Inhalation wird mit der tiefen Ausatmung (Ausnahme Vernebler) sichergestellt, dass bei der darauf erfolgenden tiefen Inspiration das Aerosol mit allen Teilen des Bronchialbaums in Kontakt gebracht wird. Dosieraerosole werden vor der Anwendung geschüttelt.
2. Bei der Inhalation unterscheiden sich Dosieraerosole und Vernebler von Pulverinhalatoren:
- Dosieraerosole und Vernebler erfordern eine möglichst langsame Inspiration, weil eine zu hohe Atemstromstärke die flussabhängigen oropharyngealen Impaktionsverluste verstärkt.
- Pulverinhalatoren erfordern in den meisten Fällen eine forcierte Inhalation mit möglichst hoher Atemstromstärke. Ein starker Inhalationsfluss ist für die Dispergierung in lungengängige Partikel erforderlich. Bei Pulverinhalatoren würde ein Atemmanöver wie bei Dosieraerosolen zu einer massiven Mund-Rachen-Abscheidung und mäßiger endobronchialer Verfügbarkeit führen. Nicht jeder Patient hat eine ausreichend kräftige Atmung. Daher ist ein Pulverinhalator für kleinere Kinder oder bei einem Asthmaanfall nicht geeignet (siehe Tabelle 8).
3. Nach der Inhalation ermöglicht eine endinspiratorische Atempause von mindestens drei, eher fünf Sekunden die Sedimentation und reduziert den Verlust von in der Schwebe befindlichen Dosisanteilen. Bei der Atempause ist es wichtig, das Gerät abzusetzen, um eine versehentliche Exhalation in das Gerät zu vermeiden.
Zur Unterstützung der Beratung und Einweisung in Inhalationssysteme wurde das Patientenblatt "Asthma: Unterschiede bei Inhalier-Geräten?" entwickelt (siehe Patientenblätter bzw. abrufbar unter www.asthma.versorgungsleitlinien.de).
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Für Kinder bis zu einem Alter von fünf Jahren sollen für die Inhalation von Beta-2-Sympathomimetika oder Corticosteroiden Treibgasdosieraerosole mit Spacer bevorzugt werden. |
|
|
Die Umstellung von einer Gesichtsmaske auf ein Mundstück soll bei Kindern zu dem frühestmöglichen Zeitpunkt erfolgen. |
|
Dosieraerosole mit Spacer können auch bei Säuglingen und Kleinkindern angewendet werden, wenn diese die Atmung über das Mundstück oder die weiche Gesichtsmaske des Spacers tolerieren. Ein Mundstück ist einer Gesichtsmaske vorzuziehen, da die Nasenatmung bei Gesichtsmasken zu einer Minderung der Lungendeposition führt 27774. Bei den meisten Kindern ist ein Umstellen mit Erreichen des zweiten Lebensjahres möglich, oft auch schon früher; näherungsweise, sobald Kinder aus einer Flasche trinken können. Erfahrungswerte zeigen, dass bei Säuglingen und jüngeren Kleinkindern bis zu zehn Atemzüge notwendig sind, um die verwendete Inhalationshilfe vollständig zu entleeren. Die Tabelle 8 gibt eine Orientierung welche Inhalationssysteme bei Kindern im Vorschulalter prinzipiell geeignet sind. Dabei sind die jeweils gültigen Fachinformationen ergänzend zu nutzen. Vernebler stellen in begründeten Fällen eine Alternative dar.
In der systematischen Recherche wurde eine systematische Übersichtsarbeit 25697 identifiziert, die die Anwendung von Beta-2-Sympathomometika mit Spacern mit der von Verneblern in Akutsituationen bei Kindern mit Asthma vergleicht. Da auch ältere Kinder eingeschlossen wurden, kann die Quelle nur als indirekte Evidenz herangezogen werden. Während das Risiko für Hospitalisierungen sich im Gruppenvergleich nicht signifikant unterschied, hatten Kinder, die Spacer nutzten, eine kürzere Aufenthaltsdauer in der Notaufnahme (MD -33 Minuten (95% KI -43; -24); I² = 66%, 3 Studien, n = 398, Datenqualität moderat). Bei der Anwendung von Verneblern war das Risiko für einen Tremor höher (RR 0,64 (95% KI 0,44; 0,95, Datenqualität moderat); I² = 0%, n = 132). 25697
Tabelle 8: Prinzipiell geeignete Inhalationssysteme | Kinder bis 6 Jahre (modifiziert nach 27774)
|
Alter |
Dosieraerosol + Spacer1 |
Autohaler |
Pulverinhalator |
Vernebler Alternative in begründeten Fällen |
|---|---|---|---|---|
|
< 2 Jahre |
++ |
-- |
-- |
++ |
|
2 bis 4 Jahre |
++ |
-- |
-- |
++ |
|
4 bis 6 Jahre |
++ |
(+) |
(+)2 |
++ |
|
Nicht alle Systeme sind für die jeweilige Altersgruppe zugelassen (siehe Fachinformationen). |
||||
|
1 In Notfallsituationen oder z. B. vor dem Sport kann ein Dosieraerosol auch ohne Spacer eingesetzt werden, wenn eine gute Koordination vorausgesetzt werden kann 2 einzelne Systeme ab 4 Jahre zugelassen: individuelle Eignung prüfen |
||||
|
++: geeignet; (+): bedingt geeignet; --: nicht geeignet |
||||
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Bei Verschreibung eines Inhalationssystems soll sichergestellt werden, dass der Patient in dessen Gebrauch unterwiesen wurde und die korrekte Handhabung demonstriert und eingeübt hat. |
|
|
Wenn für die verordneten Substanzen verfügbar, soll für die Langzeittherapie nur ein Inhalationssystem (nur ein Typ eines Dosieraerosols oder eines Pulverinhalators) für die inhalative Medikation verordnet werden. |
|
|
Ein Wechsel des Inhalationssystems soll bei Fortführung der medikamentösen Therapie vermieden werden, wenn der Patient mit dem bisherigen Inhalationssystem gut zurechtgekommen ist. |
|
|
Bei jedem Wechsel des Inhalationssystems soll eine Neueinweisung des Patienten in die Handhabung des Inhalationssystems erfolgen und die Notwendigkeit einer Dosisanpassung geprüft werden. |
|
|
Die Inhalationstechnik des Patienten soll regelmäßig und insbesondere bei unzureichender Asthmakontrolle überprüft werden. |
|
In der systematischen Recherche wurden zwei systematische Übersichtsarbeiten identifiziert, die die Wirksamkeit von Instruktionen in Inhalationssysteme untersuchten 27137, 27138.
Normansell et al. 27137 fanden Hinweise, dass Kinder und Erwachsene, die eine erweiterte Instruktion in das Inhalationssystem erhielten, eine bessere Inhalationstechnik aufwiesen als die Kontrollgruppe (OR 5,00 (95% KI 1,83; 13,65); I² = 57%, 3 Studien, n = 258, Datenqualität moderat). Die Asthmakontrolle und die Häufigkeit von Exazerbationen unterschieden sich im Gruppenvergleich nicht signifikant. Des Weiteren untersuchte die Arbeit die Effektivität von Feedback-Systemen und Multimedia-Trainings. 27137 Die Datenqualität der betrachteten Endpunkte ist jedoch gering und die Fallzahlen sind niedrig.
Die systematische Übersichtsarbeit von Gillette et al. untersuchte Kinder und Jugendliche im Alter zwischen sechs und 18 Jahren: In der narrativen Synthese ergaben sich Hinweise, dass wiederholte Instruktionen in ein Inhalationssystem mit einer verbesserten Inhalationstechnik einhergingen 27138.
Ein zentraler Bestandteil der Therapie des Asthmas ist, dass dem Patienten die Anwendung der verordneten Inhalationssysteme erläutert wird. Nur so kann gewährleistet werden, dass das jeweilige Medikament den Wirkort erreicht und dort adäquat wirken kann. Bei Verwendung eines Demogerätes sind hygienische Standards einzuhalten. Die Inhalte, die die Autoren bei einer Erstunterweisung in ein Inhalationssystem (Instruktion) für wichtig erachten, sind:
- die Funktionsweise des Inhalators anhand eines Demogerätes oder des eigenen Inhalationsgerätes erläutern und dabei Einzelschritte soweit möglich begründen;
- den korrekten Gebrauch unter Zuhilfenahme eines Demogerätes oder des eigenen Inhalationsgerätes demonstrieren;
- den Patienten auffordern, das Gehörte/Gezeigte mit dem Demogerät oder dem eigenen Inhalationsgerät zu reproduzieren.
Um das Risiko für Verwechslungen und/oder Fehler in der Handhabung zu minimieren, empfiehlt die Leitliniengruppe bei mehreren inhalativ applizierbaren Wirkstoffen, Inhalationssysteme des gleichen Typs zu verordnen. So ist es möglich, die Handhabungskompetenz, das Selbstmanagement sowie ggf. die Adhärenz zu verbessern. Bei Handhabungsfehlern, die trotz wiederholter Instruktion fortbestehen und Einfluss auf die Effektivität der medikamentösen Therapie haben, ist es wichtig, über einen Wechsel des Inhalationssystems nachzudenken, sofern für den entsprechenden Arzneistoff andere Inhalationssysteme zur Verfügung stehen.
Die Leitliniengruppe betont jedoch, dass jeder Wechsel eines Inhalationssystems mit der Gefahr von Handhabungsfehlern einhergehen kann. Sie rät daher von einem Wechsel ab, wenn Patienten gut mit ihrem Inhalationssystem und der Arzneimittelanwendung vertraut sind. Für den Fall, dass der Wechsel des Inhalationssystems unvermeidbar ist, ist eine erneute Einweisung unverzichtbar (siehe auch Kapitel 13.3 Kooperation von Arzt und Apotheker).
Inwieweit sich der Wechsel eines Inhalationssystems ohne eine erneute Instruktion auf asthmaspezifische Endpunkte auswirkt, wurde mit Hilfe einer systematischen Recherche ohne Einschränkung des Studientyps geprüft. Identifiziert wurden eine qualitative Studie 26959 und zwei Auswertungen von Registerdaten 26961, 26956.
Doyle et al. 26959 befragten 19 Patienten in qualitativen Interviews. Patienten, deren Inhalationssystem ohne ihr Wissen gewechselt wurde, berichteten von Schwierigkeiten in der Handhabung. Einige Patienten gaben an, sogar auf die Anwendung des Gerätes verzichtet zu haben, andere hingegen nutzten es häufiger, da sich nach der Anwendung keine Wirkung zeigte. Die meisten der Befragten berichteten von einer Verschlechterung der Symptome und der Asthmakontrolle. 26959
In einer retrospektiven Kohortenstudie 26961 mit 1 648 Patienten ergaben sich Hinweise, dass der Wechsel des Inhalationssystems ohne eine erneute Konsultation des Arztes zu einer Verschlechterung der Asthmakontrolle führte (OR 0,30 (95% KI 0,20; 0,45)). Die Wahrscheinlichkeit für Hospitalisierungen unterschied sich im Gruppenvergleich nicht signifikant. 26961
Die Subgruppenanalyse einer schwedischen retrospektiven Kohortenstudie 26956 verglich Patienten, die am Tag des Wechsels des Inhalationssystems keinen Arztkontakt hatten (wahrscheinlich nicht intendierter Wechsel) mit solchen, die einen Arztkontakt hatten (wahrscheinlich intendierter Wechsel). Patienten ohne Arztkontakt suchten in der Folge häufiger ambulant das Krankenhaus auf als Patienten mit Arztkontakt (2,01 vs. 0,81). Exazerbationen unterschieden sich im Gruppenvergleich nicht signifikant (0,90 vs. 0,77). 26956
Zur Unterstützung der Aufklärung und Beratung der Patienten wurde das Patientenblatt "Asthma: Wechsel des Inhalier-Gerätes" (siehe Patientenblätter bzw. abrufbar unter www.asthma.versorgungsleitlinien.de) entwickelt.
Wie oft die Inhalationstechnik überprüft wird, hängt vom Umgang des Patienten mit dem verordneten Inhalationssystem ab. Häufigere Kontrollen sind empfehlenswert, wenn die Asthmakontrolle unzureichend ist, Handhabungsfehler auftreten oder bei der Neueinstellung auf ein Inhalationssystem. Bei Kindern ist es wichtig, die Inhalationstechnik bei jeder Konsultation zu überprüfen.
4.12 Impfschutz bei Patienten mit Asthma
|
Empfehlungen/Statements |
Empfehlungsgrad |
|---|---|
|
Asthma erhöht, wie andere chronische Erkrankungen, das Risiko, an Influenza und Pneumokokkeninfektionen zu erkranken. Patienten mit Asthma sollen daher Impfungen gemäß den Empfehlungen der STIKO angeboten werden. |
|
Die systematische Recherche identifizierte eine systematische Übersichtsarbeit 25786, die Influenzaimpfungen bei Patienten mit Asthma untersuchte und einen HTA-Bericht, der lebend-attenuierte inaktivierte Impfstoffe gegen Influenza (LAIV) bei Kindern evaluierte 25400. Die Recherche wurde im Dezember 2017 systematisch aktualisiert, wobei eine weitere systematische Übersichtsarbeit gefunden wurde 27661.
Der Cochrane-Review von Cates et al. 25786 untersuchte die Wirksamkeit inaktivierter Influenzavakzine zum Zeitpunkt der Influenzasaison. In einer Studie mit 696 Kindern unterschieden sich weder Exazerbationen noch Influenza-bezogene Exazerbationen im Vergleich zu Placebo, allerdings waren die Symptome bei geimpften Kindern weniger schwer. Unerwünschte Wirkungen wurden zu verschiedenen Zeitpunkten – nach drei Tagen und nach zwei Wochen – evaluiert. Das Risiko für Exazerbationen war zu beiden Zeitpunkten im Vergleich zur Placebogruppe nicht signifikant verändert. Auch die Ergebnisse für die Endpunkte Schul- und Arbeitsabwesenheit, Inanspruchnahme des Gesundheitswesens und Medikamentennutzungen unterschieden sich nicht signifikant im Gruppenvergleich. 25786
Die Autoren des Cochrane-Reviews 25786 vergleichen zudem die Anwendung einer LAIV mit Placebo sowie mit einer intramuskulären Injektion von trivalenten inaktivierten Spaltimpfstoffen. In beiden Vergleichen errechnete sich kein signifikanter Unterschied hinsichtlich des Exazerbationsrisikos. Der Cochrane-Review schlussfolgerte ein unklares Ausmaß des Nutzens der Impfung, sah aber auch kein Risiko für eine Verschlechterung der Asthmasymptomatik direkt nach der Impfung. 25786
Anderson et al. 25400 fassten in ihrem HTA-Bericht zusammen, dass die Anwendung von LAIV bei Kindern in einem Alter von zwei bis 17 Jahren eine Reduktion der Influenzaerkrankungen ermöglichen konnte. Sie wiesen jedoch auf die Notwendigkeit einer steten Untersuchung von Wirksamkeit und Sicherheit hin, da zum Zeitpunkt der Erstellung des HTA-Berichtes keine Daten aus dem deutschen Versorgungsbereich vorlagen. 25400
Die systematische Übersichtsarbeit von Vasileiou et al. 27661 aus dem Jahr 2017 betrachtete neben RCTs auch epidemiologische Studien und untersuchte die Impfeffektivität gegen Influenzainfektion und Exazerbationen. Eine Metaanalyse von zwei Studien mit Test-negativem Design ergab eine gepoolte Impfeffektivität bezüglich der Prävention von im Labor nachgewiesenen Influenzainfektionen von 45% (95% KI 31; 56); n = 1 825 27661.
Die Leitliniengruppe beurteilt die Evidenz für die Effektivität der Impfung aus RCTs bei unzureichender Datenlage als unklar. Zudem wird davon ausgegangen, dass Placebo-kontrollierte RCTs aufgrund der bestehenden offiziellen Impfempfehlungen nicht mehr durchgeführt werden. Daher werden auch die Ergebnisse neuerer, großer Beobachtungsstudien mit Test-negativem Design zur Entscheidungsfindung herangezogen. Führend ist dabei die Überlegung, dass Menschen mit Asthma aufgrund der chronischen Atemwegserkrankung eine vulnerable Patientengruppe darstellen. Vor diesem Hintergrund sieht die Leitliniengruppe bei inkonklusiver Evidenzlage die prinzipielle Chance, Menschen mit Asthma vor Infektionen zu schützen, als wichtiges Ziel an, da gleichzeitig keine relevanten Hinweise auf Schäden durch die Intervention vorliegen. Zu den Details der Impfempfehlungen verweist die Leitliniengruppe auf die STIKO.
Es wurden weder in der systematischen Recherche im Februar 2016 noch in der Updaterecherche im Dezember 2017 systematische Übersichtsarbeiten identifiziert, die anhand von Interventionsstudien die Wirksamkeit und Sicherheit einer Impfung gegen Pneumokokken bei Menschen mit Asthma evaluieren.
Mehr zur NVL Asthma
-
NVL Asthma, 4. Auflage – Kurzfassung
Bietet einen schnellen Überblick über Empfehlungen, Tabellen und Algorithmen.
-
Dokumentationsbogen arbeitsplatzbezogene Anamnese
Praxishilfe
-
Asthma – Haustier abgeben bei Tierallergie
Sie werden weitergeleitet auf unsere Seite Patienten-Information.de
-
Asthma – Langzeitbehandlung mit Kortison-Spray
Sie werden weitergeleitet auf unsere Seite Patienten-Information.de
-
Asthma – Unterschiede bei Inhalier-Geräten
Sie werden weitergeleitet auf unsere Seite Patienten-Information.de
-
Asthma – Wechsel des Inhalier-Gerätes
Sie werden weitergeleitet auf unsere Seite Patienten-Information.de
-
Asthma – Warum Rauchstopp hilft
Sie werden weitergeleitet auf unsere Seite Patienten-Information.de
-
Asthma – Kinderwunsch, Schwangerschaft und Geburt
Sie werden weitergeleitet auf unsere Seite Patienten-Information.de
-
Patientenleitlinie Asthma
Sie werden weitergeleitet auf unsere Seite Patienten-Information.de.
-
Asthma – wenn Atmen schwerfällt
Sie werden weitergeleitet auf unsere Seite Patienten-Information.de
Bitte beachten Sie, dass nur die unter www.leitlinien.de enthaltenen Dokumente des Programms für Nationale VersorgungsLeitlinien durch die Träger des NVL-Programms autorisiert und damit gültig sind. Bei NVL-Dokumenten, die Sie von anderen Webseiten beziehen, übernehmen wir keine Verantwortung für deren Gültigkeit.
-
Langfassung
PDF zum Download
Das Archiv enthält abgelaufene, zurückgezogene Dokumente zur Nationalen Versorgungsleitlinie Asthma.
-
Langfassung, 4. Auflage, Version 1
ersetzt durch Version 5 am 23. August 2024
-
Langfassung, 4. Auflage, Konsultation
ersetzt durch 4. Auflage, Version 1 am 7. September 2020
-
Langfassung, 3. Auflage, Version 1
ersetzt durch 4. Auflage am 7. September 2020
-
Langfassung, 3. Auflage, Konsultation
Konsultationsphase beendet
-
Langfassung, 2. Auflage, Version 5
Gültigkeit abgelaufen, NVL in Überprüfung
-
Langfassung, 2. Auflage, Version 1.3
ersetzt durch Version 5.0 im August 2013. Begründung: Grundsätzliche Änderung der vorgegebenen Gültigkeit aller NVL von vier auf fünf Jahre, Einführung neuer Versionsnummerierung, Ergänzung der DOI sowie redaktionelle Änderungen
-
Langfassung, 2. Auflage, Version 1.2
ersetzt durch Version 1.3 im Juli 2011. Begründung: Korrektur von Angaben in der Wirkstofftabelle (Kapitel 4) und redaktionelle Korrekturen
-
Begleitdokument zur NVL Asthma, 2. Auflage, Version 1.2
ersetzt durch Version 1.3
-
Langfassung, 2. Auflage, Version 1.1
ersetzt durch Version 1.2 im November 2010. Begründung: Inhaltliche und redaktionelle Änderungen, Zusammenfassung
-
Langfassung, 2. Auflage, Version 1.0
ersetzt durch Version 1.1 im März 2010. Begründung: Redaktionelle Änderungen im Impressum
-
Langfassung, 2. Auflage, Konsultationsentwurf, Version 1.0
ersetzt durch Finalversion 1.0. Begründung: Ende der Konsultationsphase am 09. Mai 2009
-
Langfassung, 1. Auflage, Version 1.5
ersetzt durch Version 1.0 der Konsultationsfassung zur 2. Auflage im Februar 2009. Begründung: Erscheinen der Konsultationsfassung zur 2. Auflage
-
Langfassung, 1. Auflage, Version 1.4
ersetzt durch Version 1.5 im April 2008. Begründung: Redaktionelle Überarbeitung, Empfehlungsgrad für "Empfehlung offen" von "C" in "0" geändert
-
Langfassung, 1. Auflage, Version 1.3
ersetzt durch Version 1.4 im März 2007. Begründung: Redaktionelle Überarbeitung, Tabelle S. 9: Empfehlungsgrad von "0" in "C" geändert
-
Langfassung, 1. Auflage, Version 1.2
ersetzt durch Version 1.3 im Februar 2006. Begründung: Redakt. Modifikation des Stufenschemas für Erwachsene zur besseren Verständlichkeit ohne inhaltliche Änderung
-
Langfassung, 1. Auflage, Version 1.1
ersetzt durch Version 1.2 im Februar 2006. Begründung: Redakt. Modifikation des Stufenschemas für Erwachsene zur besseren Verständlichkeit ohne inhaltliche Änderung
-
Langfassung, 1. Auflage, Version 1.0
ersetzt durch Version 1.1 im September 2005
-
Kurzfassung, 2. Auflage, Version 5
Gültigkeit abgelaufen, NVL in Überprüfung
-
Kurzfassung, 2. Auflage, Version 1.3
ersetzt durch Version 5.0, im August 2013. Begründung: Grundsätzliche Änderung der vorgegebenen Gültigkeit aller NVL von vier auf fünf Jahre, Einführung neuer Versionsnummerierung, Ergänzung der DOI sowie redaktionelle Änderungen
-
Kurzfassung, 2. Auflage, Version 1.2
ersetzt durch Version 1.3 im Juli 2011. Begründung: Korrektur von Angaben in der Wirkstofftabelle (Kapitel 4) und redaktionelle Korrekturen
-
Kurzfassung, 2. Auflage, Version 1.1
ersetzt durch Version 1.2 im November 2010. Begründung: Inhaltliche und redaktionelle Änderungen
-
Kurzfassung, 2. Auflage, Version 1.0
ersetzt durch Version 1.1 im März 2010. Begründung: Redaktionelle Änderungen im Impressum
-
Kurzfassung, 2. Auflage, Konsultationsentwurf, Version 1.0
ersetzt durch Finalversion 1.0. Begründung: Ende der Konsultationsphase am 09. Mai 2009
-
Kurzfassung, 1. Auflage, Version 1.5
ersetzt durch Version 1.0 der Konsultationsfassung zur 2. Auflage. Begründung: Erscheinen der Konsultationsfassung zur 2. Auflage
-
Kurzfassung, 1. Auflage, Version 1.4
ersetzt durch Version 1.5 im April 2008. Begründung: Redaktionelle Überarbeitung, Empfehlungsgrad für "Empfehlung offen" von "C" in "0" geändert
-
Kurzfassung, 1. Auflage, Version 1.3
ersetzt durch Version 1.4 im März 2007. Begründung: Redaktionelle Überarbeitung, Tabelle S.9: Empfehlungsgrad von "0" in "C" geändert
-
Kurzfassung, 1. Auflage, Version 1.2
ersetzt durch Version 1.3 im Februar 2006. Begründung: Redakt. Modifikation des Stufenschemas für Erwachsene zur besseren Verständlichkeit ohne inhaltliche Änderung
-
Kurzfassung, 1. Auflage, Version 1.1
ersetzt durch Version 1.2 im Februar 2006. Begründung: Redakt. Modifikation des Stufenschemas für Erwachsene zur besseren Verständlichkeit ohne inhaltliche Änderung
-
Leitlinienreport zur Konsultationsfassung, 4. Auflage
ersetzt durch 4. Auflage, Version 1 am 7. September 2020
-
Leitlinienreport, 3. Auflage, Version 1
ersetzt durch 4. Auflage am 7. September 2020
-
Leitlinien-Report, 2. Auflage, Version 2
Gültigkeit abgelaufen, NVL in Überprüfung
-
Leitlinien-Report, 2. Auflage, Version 1.0
ersetzt durch Version 2, im August 2013. Begründung: Grundsätzliche Änderung der vorgegebenen Gültigkeit aller NVL von vier auf fünf Jahre, Einführung neuer Versionsnummerierung, Ergänzung der DOI sowie redaktionelle Änderungen
-
Leitlinien-Report, 1. Auflage, Version 1.3
ersetzt durch Version 1.0, 2. Aufl. im Februar 2009. Begründung: Fertigstellung der Konsultationsfassung der Langfassung zur 2. Auflage
-
Leitlinien-Report, 1. Auflage, Version 1.2
ersetzt durch Version 1.3 im April 2008. Begründung: Redaktionelle Überarbeitung, Empfehlungsgrad für "Empfehlung offen" von "C" in "0" geändert
-
PatientenLeitlinie, 3. Auflage, Konsultationsfassung
ersetzt durch 3. Auflage, Version 1 im Juni 2021.
-
PatientenLeitlinie, 2. Auflage, Version 1.3
Ersetzt durch 3. Auflage, Version 1 im Juni 2021
-
PatientenLeitlinie, 2. Auflage, Version 1.2
ersetzt durch Version 1.3 im Juli 2011. Begründung: Korrekturen im Rahmen der Erstellung der Version 1.3 der Langfassung
-
PatientenLeitlinie, 2. Auflage, Version 1.1
ersetzt durch Version 1.2 im November 2010. Begründung: Inhaltliche und redaktionelle Änderungen
-
PatientenLeitlinie, 2. Auflage, Version 1.0
ersetzt durch Version 1.1, im März 2010. Begründung: Redaktionelle Änderungen im Impressum
-
PatientenLeitlinie, 2. Auflage, Konsultationsentwurf
Finalfassung in Bearbeitung. Begründung: Ende der Konsultationsphase am 07. August 2009
-
PatientenLeitlinie, 1. Auflage, Version 1.3
ersetzt durch Version 1.0 der 2. Auflage im Mai 2009. Begründung: Veröffentlichung der Konsultationsfassung zur 2. Auflage
-
PatientenLeitlinie, 1. Auflage, Version 1.2
ersetzt durch Version 1.3 im September 2008. Begründung: Erstellung einer barrierefreien Version des pdf-Dokumentes
-
PatientenLeitlinie, 1. Auflage, Version 1.1
ersetzt durch Version 1.2 im Dezember 2007. Begründung: Verlängerung der Gültigkeitsdauer bis 2010
-
PatientenLeitlinie - Methodenreport, 2. Auflage, Version 1.0
Ersetzt durch 3. Auflage, Version 1 im Juni 2021

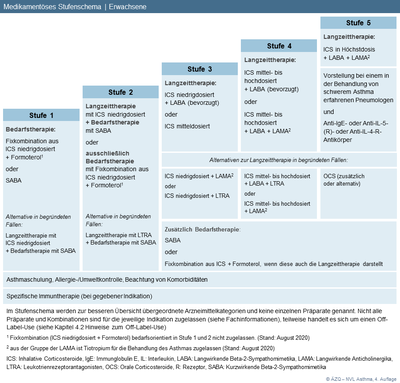
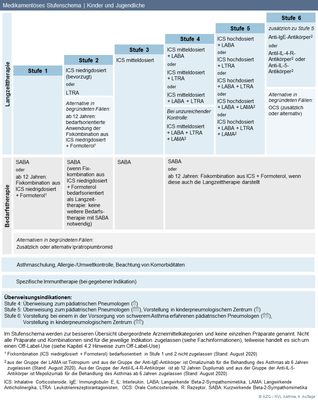


Hinweise und Kommentare
Sie haben Hinweise und Kommentare zu unserem Internetangebot?